题目内容
【题目】氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室中以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下:
 已知:①Cr2O72-+H2O
已知:①Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
③甲醇,无色液体,有毒,沸点64.7,易燃。
请回答:
(1)碱溶的目的是____,所加40%NaOH不宜过量太多的原因是____。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,该反应的离子方程式为____。
(3)使用下列用品来测定溶液的pH,合理的是____(填字母)。
A.pH计 B.pH试纸 C.酚酞溶液
(4)使用下图装置从滤液中分离出CH3OH。
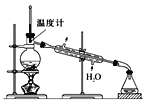
①该装置中存在的错误是____。
②在改正后的装置中,在仪器A中加入沸石,再加入滤液,蒸馏,收集蒸馏出的CH3OH循环使用。有的同学认为,该过程中需要加入CaO,防止水随CH3OH一起蒸出,你认为是否有必要并说明理由:____。
(5)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得固体____,____,冷却结晶,过滤,____,低温干燥,得到CrCl3·6H2O。
(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)
【答案】 将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-) 避免还原时消耗过多盐酸 10H++2CrO42-+CH3OH=2Cr3++7H2O+ CO2↑ AB 用明火加热、体系封闭 没有必要,CH3OH参与反应的体系中有水 完全溶解于过量的盐酸中 蒸发浓缩 用乙醚洗涤固体2~3次
【解析】用40%NaOH将红矾钠(Na2Cr2O7)转化为铬酸钠(Na2CrO4),再用CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液,加20%NaOH使Cr3+沉淀为Cr(OH)3,过滤,将过滤后所得固体用盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,低温干燥,即得CrCl36H2O晶体。
(1)碱溶使Cr2O72-+H2O2CrO42-+2H+的平衡正向移动,将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-);所加40%NaOH不宜过量太多,因后需加更多的盐酸还原,故答案为:将红矾钠(或Cr2O72-)转化为铬酸钠(或CrO42-);避免还原时消耗过多盐酸;
(2)CH3OH将铬酸钠(Na2CrO4)还原为CrCl3溶液,反应为10H++2CrO42-+CH3OH= 2Cr3++7H2O+CO2↑,故答案为:10H++2CrO42-+CH3OH=2Cr3++7H2O+CO2↑;
(3)测定溶液的pH可用pH计、pH试纸,故答案为:AB;
(4)①根据题意,甲醇易燃,不能用明火加热,装置最后的锥形瓶没有出气口,是一个封闭体系,故答案为:用明火加热、体系封闭;
②CH3OH参与反应的体系是水溶液,因此没有必要加入CaO,故答案为:没有必要,CH3OH参与反应的体系中有水;
(5)过滤后所得Cr(OH)3用过量的盐酸溶解,最后将CrCl3的HCl溶液进行蒸发浓缩、冷却结晶、过滤并用乙醚洗涤2~3次,即得CrCl36H2O晶体,故答案为:完全溶解于过量的盐酸中;蒸发浓缩;用乙醚洗涤固体2~3次。

