题目内容
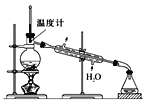
【题目】如图所示,“二氧化碳是否在有水存在时,才能与过氧化钠反应?”这个问题可通过以下实验加以证明。

(1)按图装置,在干燥的试管Ⅲ中装入Na2O2后,在通入CO2之前,应事先将活塞(K1、K2)关闭好,目的何在?____。
(2)试管I内的试剂X是__时,打开活塞K1、K2,加热试管Ⅲ约5分钟后,将带火星的小木条插入试管Ⅱ的液面上,可观察到带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,则所得的结论是____。
(3)试管I内试剂为CO2饱和水溶液时,其他操作同(2),通过____的现象,可以证明Na2O2与潮湿的CO2能反应且放出O2。
(4)CO2与过氧化钠反应机理也可用示踪原子分析加以证明,请完成下列反应方程式:
__Na2O2+____C18O2+____H218O→____。
【答案】 以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象 浓H2SO4 过氧化钠与干燥的CO2不反应 带火星的小木条在试管Ⅱ的液面上复燃,同时,Ⅲ内固体由淡黄色变为白色 2 2 2 ═2Na2C18O3+O2↑+2H2O
【解析】(1)本题旨在利用对比实验,探究Na2O2与CO2反应的环境,故实验步骤中,首先让Na2O2与干燥CO2反应,必须保证整个环境中不能有H2O,故通入反应装置前CO2必须干燥,故答案为:以防止试管Ⅲ内的过氧化钠和外界相通时发生吸潮现象;
(2)二氧化碳必须是干燥的,所以使用试剂X浓硫酸进行干燥;由带火星的小木条不能剧烈地燃烧起来,且Ⅲ内淡黄色粉末未发生变化,说明干燥的 二氧化碳与过氧化钠没有发生反应,故答案为:浓H2SO4;过氧化钠与干燥的CO2不反应;
(3)过氧化钠与潮湿的二氧化碳反应会生成氧气,所以带火星的小木条在试管Ⅱ的液面上会复燃;Ⅲ内固体由淡黄色变为白色,说明淡黄色的过氧化钠由于参加了反应生成了白色的碳酸钠,故答案为:带火星的小木条在试管Ⅱ的液面上复燃,同时,Ⅲ内固体由淡黄色变为白色;
(4)过氧化钠与潮湿的二氧化碳反应的实质为:二氧化碳与水结合生成碳酸,碳酸电离的氢离子与过氧化钠反应,碳酸中18O完全存在于碳酸根离子中,生成的水中不含18O,反应的化学方程式为:2Na2O2+2C18O2+2H218O═2Na2C18O3+O2↑+2H2O,故答案为:2;2;2;═2Na2C18O3+O2↑+2H2O。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】下列设计的实验方案能达到相应实验目的是( )
选项 | 实验目的 | 实验方案 |
A | 蛋白质发生了变性 | 向蛋白质溶液中加入CuCl2或(NH4)2SO4饱和溶液 |
B | 证明反应速率会随反应物浓度的增大而加快 | 用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入1mL 1mol·Lˉ1CuSO4溶液,迅速产生较多气泡 |
C | 比较Ksp(BaCO3)、Ksp(BaSO4) | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生 |
D | 通过观察液面差判断该装置的气密性 |
|
A. A B. B C. C D. D