题目内容
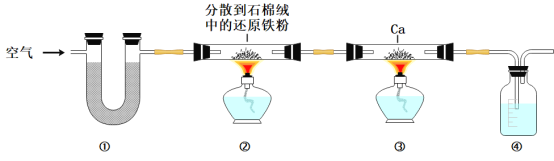
【题目】Ca3N2是重要的化学试剂,易潮解、被氧化,实验室用N2和金属钙在加热条件下制备Ca3N2的装置如图所示(已知:钙能在CO2中燃烧)。请回答下列问题:
(1)Ca3N2中所含化学键的类型为____________。
A.离子键 B.共价键 C.氢键
(2)装置①中的U型管中的物质为___________,其作用为________________。
(3)装置②的作用为___________________________。
(4)组装好仪器,装入药品,通入空气后,应先点燃____________处酒精灯,再点燃另一个酒精灯。
(5)写出Ca3N2潮解时的化学方程式__________________________。
【答案】A 碱石灰 除去空气中的水和二氧化碳 除去空气中的氧气 ② Ca3N2+6H2O=3Ca(OH)2+2NH3↑
【解析】
制备Ca3N2的流程:装置①除去空气中的水和二氧化碳,空气通过装置①后主要为氮气、氧气的混合气体;装置②分散到石棉中的还原性铁粉与通过装置①后的混合气体中的氧气反应;装置③N2和金属钙在加热条件下制备Ca3N2;N2+3Ca![]() Ca3N2,氮化钙遇水立即发生剧烈反应,装置④防止空气中的水蒸气进入装置③中。
Ca3N2,氮化钙遇水立即发生剧烈反应,装置④防止空气中的水蒸气进入装置③中。
(1)Ca3N2的电子式为![]() ,只含离子键,故答案为:A;
,只含离子键,故答案为:A;
(2)金属钙的活动性很强,遇水立刻剧烈反应生成氢氧化钙,同时产生氢气,钙能在CO2中燃烧,氮化钙与水反应生成氨气,所以需除去空气中的水和二氧化碳,碱石灰是固体氢氧化钠和氧化钙的混合物,能吸收水和二氧化碳,所以装置①中的U型管中的物质为碱石灰;
(3)装置②分散到石棉中的还原性铁粉与通过装置①后的混合气体中的氧气反应,生成四氧化三铁,所以作用为除去空气中的氧气;
(4)实验开始先使②装置的反应发生,排除混合气体中的氧气,装置②分散到石棉中的还原性铁粉与通过装置①后的混合气体中的氧气反应,实验结束,先停止③处的热源,故应先点燃②处酒精灯,再点燃另一个酒精灯,故答案为:②;
(5)氮化钙与水反应生成氢氧化钙和氨气,发生反应的化学方程式Ca3N2+6H2O=3Ca(OH)2+2NH3↑。

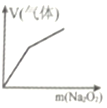
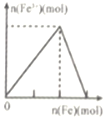
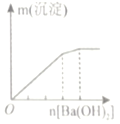
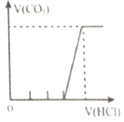
【题目】下列实验与图象不对应的是
选项 | A | B | C | D |
实验 | 向NH4C1溶液中加入过量Na2O2固体 | 向稀硝酸溶液中加入过量的铁粉 | 明矾溶液中逐滴加Ba(OH)2溶液至过量 | 向含等物质的量的NaOH和Na2CO3的混合溶液中滴加过量的稀盐酸 |
图象 |
|
|
|
|
A.AB.BC.CD.D
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
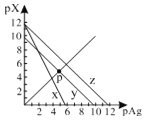
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012