题目内容
酸式盐NaHB在水溶液中,HB—的电离程度小于HB—的水解程度,下列说法正确的是( )
A.HB—水解方程式:HB-+H2O H3O+
+B2-
H3O+
+B2-
B.溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+)
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:NaHB > Na2B
【答案】
B
【解析】HB—的电离程度小于HB—的水解程度,所以溶液显碱性,所以选项B是正确的。A属于HB—的电离方程式,水解方程式为HB-+H2O H2B+OH-。NaHB的水解程度大,所以NaHB的存在促进了水的电离。B2-解程度要大于HB—的水解程度,所以相同物质的量浓度溶液的pH值是NaHB < Na2B。答案选B。
H2B+OH-。NaHB的水解程度大,所以NaHB的存在促进了水的电离。B2-解程度要大于HB—的水解程度,所以相同物质的量浓度溶液的pH值是NaHB < Na2B。答案选B。

练习册系列答案
相关题目
已知:某酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则下列说法正确的是( )
| A、HB-水解方程式:HB-+H2O?H3O++B2- | B、溶液中离子浓度大小为:c(Na+)=c(HB-)>c(OH-)=c(H+) | C、NaHB的存在抑制了水的电离 | D、相同物质的量浓度溶液的pH:Na2B>NaHB |
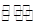 H++B2-③HB-+H2O
H++B2-③HB-+H2O