题目内容
已知:某酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则下列说法正确的是( )
| A、HB-水解方程式:HB-+H2O?H3O++B2- | B、溶液中离子浓度大小为:c(Na+)=c(HB-)>c(OH-)=c(H+) | C、NaHB的存在抑制了水的电离 | D、相同物质的量浓度溶液的pH:Na2B>NaHB |
分析:A.该方程式为电离方程式;
B.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则该溶液中c(OH-)>c(H+),溶液呈碱性,钠离子不水解,HB-水解,但水解程度较小;
C.含有弱根离子的盐促进水电离;
D.多元弱酸的盐溶液,第一步水解程度大于第二步.
B.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则该溶液中c(OH-)>c(H+),溶液呈碱性,钠离子不水解,HB-水解,但水解程度较小;
C.含有弱根离子的盐促进水电离;
D.多元弱酸的盐溶液,第一步水解程度大于第二步.
解答:解:A.该方程式为电离方程式,HB-水解方程式:HB-+H2O?H2B+OH-,故A错误;
B.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则该溶液中c(OH-)>c(H+),溶液呈碱性,钠离子不水解,HB-水解,但水解程度较小,所以c(Na+)>c(HB-),故B错误;
C.含有弱根离子的盐促进水电离,则NaHB的存在促进了水的电离,故C错误;
D.多元弱酸的盐溶液,第一步水解程度大于第二步,酸根离子水解程度越大,其相同浓度的盐溶液碱性越强,所以相同物质的量浓度溶液的pH:Na2B>NaHB,故D正确;
故选D.
B.酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,则该溶液中c(OH-)>c(H+),溶液呈碱性,钠离子不水解,HB-水解,但水解程度较小,所以c(Na+)>c(HB-),故B错误;
C.含有弱根离子的盐促进水电离,则NaHB的存在促进了水的电离,故C错误;
D.多元弱酸的盐溶液,第一步水解程度大于第二步,酸根离子水解程度越大,其相同浓度的盐溶液碱性越强,所以相同物质的量浓度溶液的pH:Na2B>NaHB,故D正确;
故选D.
点评:本题考查了盐类水解,根据酸式酸根离子水解程度和电离程度的相对大小确定溶液的酸碱性,再水解的离子、水解程度大小等知识点来分析解答,注意电离和水解方程式的区别,难度不大.

练习册系列答案
相关题目
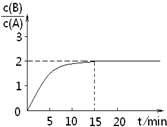 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)═B(g)+C(g);△H=-48.25kJ?mol-1
反应过程中时间t与A、B浓度有如图关系,若测得第15min时
c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、反应在前15min的平均速率ν(A)=0.11 mol?L-1?min-1 | B、A的初始物质的量为8 mol | C、反应到达平衡的过程中,放出的热量是77.2kJ | D、如使反应最终c(B)/c(A)=1.5,恒温恒容时,加入一定量的A可以实现 |
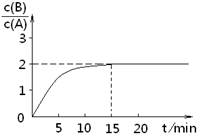 已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:
已知,某温度下在2L密闭容器中加入一定量A,发生以下化学反应:2A(g)?B(g)+C(g);△H=-48.25kJ?mol-1反应过程中时间t与A、B浓度有下图所示关系,若测得第15min时c(B)=1.6mol?L-1,则下列结论正确的是( )
| A、该温度下此反应平衡常数为3.2 | B、A的初始物质的量为4 mol | C、反应到达平衡的过程中,放出的热量是154.4kJ | D、如使反应最终c(B)/c(A)=3,只能降低反应温度 |

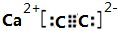
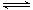 B(g)+C(g);ΔH =-48.25 kJ
· mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,则下列结论正确的是
B(g)+C(g);ΔH =-48.25 kJ
· mol-1反应过程中时间t与A 、B浓度有下图所示关系,若测得第15min时c(B)=1.6 mol·L-1,则下列结论正确的是