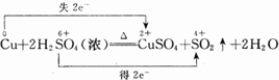
题目内容
在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,氧化剂是
H2SO4
H2SO4
;被氧化的元素是Cu
Cu
,每生成11.2L(标准状况)的SO2,转移的电子的物质的量为1
1
mol.分析:在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,被氧化,H元素化合价降低,被还原,结合化合价的升降计算电子转移的数目.
解答:解:在Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,被氧化,H元素化合价降低,被还原,则硫酸为氧化剂,
每生成11.2L(标准状况)的SO2,n(SO2)=0.5mol,则转移的电子的物质的量为1mol,
故答案为:H2SO4;Cu;1.
每生成11.2L(标准状况)的SO2,n(SO2)=0.5mol,则转移的电子的物质的量为1mol,
故答案为:H2SO4;Cu;1.
点评:本题考查氧化还原反应,题目难度不大,注意从元素化合价变化的角度解答该题,注意可从元素化合价变数的数值计算转移的电子数目.

练习册系列答案
相关题目