题目内容
9.下列叙述不正确的是( )| A. | 用电子式表示HCl的形成过程: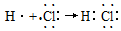 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
分析 A.HCl是共价化合物;
B.质子数=核外电子数=87,质量数为166,则中子数为166-87=79;
C.Li的金属性较弱,与氧气反应生成氧化锂;
D.Na2O2含离子键、O-O非极性键,H2O2含O-H极性键、O-O非极性键.
解答 解:A.HCl是共价化合物,H原子和Cl原子通过电子对的共用形成共价键,故用电子式表示形成过程为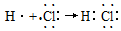 ,故A正确;
,故A正确;
B.质子数=核外电子数=87,质量数为166,则中子数为166-87=79,则核外电子数与中子数的差是87-79=8,故B错误;
C.Li的金属性较弱,与氧气反应生成氧化锂,反应为4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O,故C正确;
D.Na2O2含离子键、O-O非极性键,H2O2含O-H极性键、O-O非极性键,则化学键不完全相同,故D正确;
故选B.
点评 本题考查较综合,涉及化合物的形成、原子构成、物质的性质及化学键,为高频考点,把握原子中数量关系、化合物与化学键为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
20.下列说法错误的是( )
| A. | 煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 | |
| B. | 氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂 | |
| C. | 日常生活中人们大量使用铝制品,是因为常温下铝不能与氧气反应 | |
| D. | 我国神舟系列飞船所用太阳能电池板可将光能转换为电能,所用转换材料是晶体硅 |
17.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯酚能跟浓溴水反应而乙醇不能 | |
| B. | 乙炔能发生加成反应而乙烷不能 | |
| C. | 钠与乙醇反应缓慢而与水反应剧烈 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
5.25℃时,0.1mol/L下列溶液的pH如下表,有关比较正确的是( )
| 序号 | ① | ② | ③ | ④ | ⑤ |
| 溶液 | NaCl | CH3COONH4 | NaClO | NaHCO3 | Na2CO3 |
| pH | 7.0 | 7.0 | 10.3 | 8.3 | 11.6 |
| A. | 酸性的相对强弱:HClO<HCO3- | |
| B. | 在④⑤溶液等体积混合后的溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol/L | |
| C. | 由水电离产生的c(H+):①=② | |
| D. | 溶液③④中酸根离子浓度:c(ClO-)>c(HCO3-) |
6.氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价,NaH和水反应放出氢气,下列叙述中正确的是( )
| A. | NaH在水中显酸性 | |
| B. | NaH中氢离子电子层排布与氦原子的不同 | |
| C. | NaH中氢离子半径比锂离子大 | |
| D. | NaH中氢离子可被还原成氢气 |
 的名称是2-甲基丁烷;
的名称是2-甲基丁烷; ;
; .
. ;
;