题目内容
8.基态C原子中,电子运动状态有6种,电子占据的最高能级符号为2p,该能级含有的轨道数为3.分析 基态C原子的电子排布式为1s22s22p2,核外电子数为6,离原子核越远的能量越高,s能级有1个轨道,p能级有3个轨道,以此来解答.
解答 解:基态C原子的电子排布式为1s22s22p2,核外电子数为6,电子运动状态有6种,电子占据的最高能级符号为2p,该能级含有的轨道数为3,
故答案为:6;2p;3.
点评 本题考查原子核外电子排布,为高频考点,把握电子排布、能级与能量为解答的关键,侧重分析与应用能力的考查,注意能级含有的轨道,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.海洋资源的开发与利用具有广阔的前景.某地海水中主要离子的含量如表:
(1)海水中提取的NaCl是氯碱工业的原料,写出氯碱工业反应原理的离子方程式2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.
(2)①该海水中Mg2+的物质的量浓度为0.05mol/L.
②检验该海水中的Mg2+时,需要排除Ca2+可能带来的干扰,设计如下实验:
(3)工业上从海水提镁的流程如图:

①沉淀池中反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
②操作a是蒸发浓缩、冷却结晶、过滤洗涤、干燥.
③操作b是在干燥的HCl气流中加热脱水,请解释“干燥的HCl气流”的作用:防止镁离子水解生成氢氧化镁,带走水蒸气.
(4)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阳极的电极反应式为4OH--4e-=2H2O+O2↑.
②淡水的出口为a、b、c中的b出口.
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
(2)①该海水中Mg2+的物质的量浓度为0.05mol/L.
②检验该海水中的Mg2+时,需要排除Ca2+可能带来的干扰,设计如下实验:
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |

①沉淀池中反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
②操作a是蒸发浓缩、冷却结晶、过滤洗涤、干燥.
③操作b是在干燥的HCl气流中加热脱水,请解释“干燥的HCl气流”的作用:防止镁离子水解生成氢氧化镁,带走水蒸气.
(4)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阳极的电极反应式为4OH--4e-=2H2O+O2↑.
②淡水的出口为a、b、c中的b出口.
9.下列叙述不正确的是( )
| A. | 用电子式表示HCl的形成过程: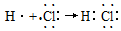 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
3.下列离子方程式书写不正确的是( )
| A. | 碳酸钙和稀盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═2Fe2++Fe3++4H2O | |
| C. | 将金属铝加入NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ |
13.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )

| A. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去 | |
| C. | 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生 | |
| D. | 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
17.下列有关化学反应表达正确的是( )
| A. | 1-丙醇与浓氢溴酸反应:CH3CH2CH2OH+HBr $\stackrel{△}{→}$CH3CH2CH2Br+H2O | |
| B. | 服用阿司匹林过量出现水杨酸(  )中毒反应,可静脉注射 NaHCO3溶液: )中毒反应,可静脉注射 NaHCO3溶液: +2 HCO3-→ +2 HCO3-→ +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| C. | 向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 向丙氨酸钠中加入足量盐酸: |
18.下列离子方程式正确的是( )
| A. | 硫化亚铁和稀盐酸反应:S2-+2 H+→H2S↑ | |
| B. | 用氢氧化钠溶液吸收少量二氧化硫气体:SO2+2OH-→SO32-+H2O | |
| C. | 硫酸和氢氧化钡溶液反应:Ba2++SO42-→BaSO4↓ | |
| D. | 醋酸和碳酸钙反应:2H++CaCO3→Ca2++CO2↑+H2O |
 某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空:
某化学实验小组用右图所示的装置制取乙酸乙酯,并检验乙酸乙酯中是否含有乙酸杂质(铁架台、夹子等支撑仪器省略).已知乙酸乙酯的沸点为77.1℃,乙醇沸点为78.4℃,乙酸的沸点为118℃.请根据要求填空: