题目内容
17.下列事实不能用有机物分子内基团间的相互作用解释的是( )| A. | 苯酚能跟浓溴水反应而乙醇不能 | |
| B. | 乙炔能发生加成反应而乙烷不能 | |
| C. | 钠与乙醇反应缓慢而与水反应剧烈 | |
| D. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 |
分析 A.苯酚中酚-OH影响苯环,苯环上H易被取代;
B.乙炔含碳碳三键,乙烷为饱和烃;
C.乙醇、水中-OH连接基团不同;
D.甲苯中甲基影响苯环,苯环上H易被取代.
解答 解:A.苯酚、乙醇均含-OH,苯酚中酚-OH影响苯环,苯环上H易被取代,则苯酚易与溴水发生取代反应,而乙醇不能,与有机物分子内基团间的相互作用有关,故A不选;
B.乙炔含碳碳三键,乙烷为饱和烃,则乙炔发生加成反应,而乙烷不能,与官能团有关,故B选;
C.乙醇、水中-OH连接基团不同,则乙醇与Na反应缓慢,与有机物分子内基团间的相互作用有关,故C不选;
D.苯、甲苯均不含官能团,甲苯中甲基影响苯环,苯环上H易被取代,则甲苯易发生硝化反应,与有机物分子内基团间的相互作用有关,故D不选;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意官能团与性质、基团相互影响的判断,题目难度中等.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
7.下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应 ②乙烯:衡量一个国家石油化工发展水平的标志,可以发生加成反应 ③苯:平面结构,分子中的碳碳键是单键和双键④油脂:属于高分子化合物,可以发生水解反应 ⑤淀粉:属于糖类物质,遇单质碘变蓝色 ⑥蛋白质:水解的最终产物为氨基酸,氨基酸遇浓硝酸显黄色.
①甲烷:天然气的主要成分,能发生取代反应 ②乙烯:衡量一个国家石油化工发展水平的标志,可以发生加成反应 ③苯:平面结构,分子中的碳碳键是单键和双键④油脂:属于高分子化合物,可以发生水解反应 ⑤淀粉:属于糖类物质,遇单质碘变蓝色 ⑥蛋白质:水解的最终产物为氨基酸,氨基酸遇浓硝酸显黄色.
| A. | ①②③ | B. | ②④⑥ | C. | ①②⑤ | D. | ①②⑥ |
5.下列水溶液中的电离方程式书写不正确的是( )
| A. | H2O═H++OH- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHS═Na++HS- | D. | HCO3-═H++CO32- |
12.海洋资源的开发与利用具有广阔的前景.某地海水中主要离子的含量如表:
(1)海水中提取的NaCl是氯碱工业的原料,写出氯碱工业反应原理的离子方程式2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑.
(2)①该海水中Mg2+的物质的量浓度为0.05mol/L.
②检验该海水中的Mg2+时,需要排除Ca2+可能带来的干扰,设计如下实验:
(3)工业上从海水提镁的流程如图:

①沉淀池中反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
②操作a是蒸发浓缩、冷却结晶、过滤洗涤、干燥.
③操作b是在干燥的HCl气流中加热脱水,请解释“干燥的HCl气流”的作用:防止镁离子水解生成氢氧化镁,带走水蒸气.
(4)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阳极的电极反应式为4OH--4e-=2H2O+O2↑.
②淡水的出口为a、b、c中的b出口.
| 成分 | Na+ | Mg2+ | Ca2+ | K+ | Li+ | Cl- | SO42- | Br- |
| 含量/mg•L-1 | 9965 | 1200 | 400 | 380 | 0.17 | 19350 | 1200 | 67 |
(2)①该海水中Mg2+的物质的量浓度为0.05mol/L.
②检验该海水中的Mg2+时,需要排除Ca2+可能带来的干扰,设计如下实验:
| 实验操作 | 实验现象 |
| Ⅰ.取1mL海水,加入1mL0.1mol/L的NaOH溶液 | 有白色沉淀 |
| Ⅱ.取1mLCaCl2溶液,加入1mL0.1mol/L的NaOH溶液 | 无白色沉淀 |

①沉淀池中反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;
②操作a是蒸发浓缩、冷却结晶、过滤洗涤、干燥.
③操作b是在干燥的HCl气流中加热脱水,请解释“干燥的HCl气流”的作用:防止镁离子水解生成氢氧化镁,带走水蒸气.
(4)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如图所示.其中阴(阳)离子交换膜只允许阴(阳)离子通过.

①阳极的电极反应式为4OH--4e-=2H2O+O2↑.
②淡水的出口为a、b、c中的b出口.
9.下列叙述不正确的是( )
| A. | 用电子式表示HCl的形成过程: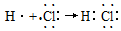 | |
| B. | ${\;}_{87}^{166}$Ho中的原子核内的中子数与核外电子数之差是99 | |
| C. | 在空气中加热金属锂:4Li+O2$\frac{\underline{\;\;△\;\;}}{\;}$2Li2O | |
| D. | Na2O2与H2O2中所含的化学键类型不完全相同 |
13.电化学在日常生活中用途广泛,图甲是镁-次氯酸钠燃料电池,电池总反应为Mg+ClO-+H2O═Cl-+Mg(OH)2↓,图乙是含Cr2O72-的工业废水的处理.下列说法正确的是( )

| A. | 图甲中发生的还原反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中Cr2O72-向惰性电极移动,与该极附近的OH-结合,转化成Cr(OH)3除去 | |
| C. | 图乙电解池中,若有0.84 g阳极材料参与反应,则阴极会有168 mL(标准状况)的气体产生 | |
| D. | 若图甲燃料电池消耗0.36 g镁产生的电量用以图乙废水处理,理论上可产生1.07g氢氧化铁沉淀 |
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Cu═2FeCl2+CuCl2