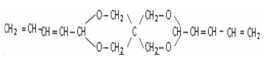
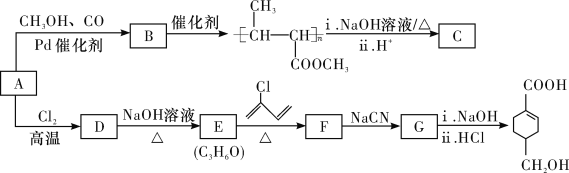
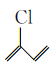
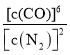题目内容
【题目】电解滴有石蕊的饱和食盐水a,以下判断正确的是( )
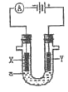
A.电解时化学能转变为电能
B.Y极附近最终变为红色
C.电子流向:X→负极→正极→Y
D.电解一段时间两极收集的气体体积:X极>Y极
【答案】D
【解析】
此装置使电解饱和食盐水,是将电能转化为化学能的装置,Y连接电源正极,Y是阳极:Cl-失去电子变成Cl2,X连接电池的负极,X是阴极:H+得到电子变成氢气,且生成OH-;
A.电解池装置是将电能转化为化学能的装置,A错误;
B. Y电极:![]() ,因为滴加的是石蕊溶液,故溶液颜色不会变红,B错误;
,因为滴加的是石蕊溶液,故溶液颜色不会变红,B错误;
C.电子的流通路径只能在导线中,电解质溶液和电池的内部是不出现电子的,所以电子的流向分两段,一段是负极→阴极,一段是阳极→正极,C错误;
D.电解的过程中阳极分两个阶段产生气体,第一阶段是:![]() ,第二阶段是:
,第二阶段是:![]() ,阴极只发生:
,阴极只发生:![]() ,根据电极方程式可得,第一阶段中理论阳极(Y)产生的Cl2和阴极(X)产生的H2相等,而且氯气会溶解于水中一部分,故Y收集的气体比X收集的较少;第二阶段阳极(Y)产生的O2比阴极(X)H2少,综合可得,电解一段时间两极收集的气体体积:X极>Y极,D正确;
,根据电极方程式可得,第一阶段中理论阳极(Y)产生的Cl2和阴极(X)产生的H2相等,而且氯气会溶解于水中一部分,故Y收集的气体比X收集的较少;第二阶段阳极(Y)产生的O2比阴极(X)H2少,综合可得,电解一段时间两极收集的气体体积:X极>Y极,D正确;
答案选D。

【题目】从含锌矿渣中提取制备锌白(ZnO)有多种方法,其中氨一碳酸氢铵法的优点是成本低。请根据以下材料,回答问题:
材料1:某矿渣的主要成份为ZnO、Fe2O3、PbO、MnO、CuO、SiO2。
材料2:主要反应原理:ZnO+NH4HCO3+3NH3=Zn(NH3)4CO3 + H2O,类似的也可以生成[Cu(NH3)4] 2+、 [Pb(NH3)4]2+这样的络合离子,这些络合离子中的金属元素同样可以被置换出来,同时锰元素会随着金属锌一起进入浸出液中。
材料3:相关阳离子的氢氧化物的Ksp数据如表所示(室温):
阳离子 | Fe2+ | Mn2+ | Pb2+ | Fe3+ | Mn4+ | Pb4+ |
Ksp | 8.0×10-16 | 4.0×10-14 | 1.2×10-15 | 4.0×10-38 | 1.9×10-13 | 3.2×10-66 |
材料4:可选氧化剂与还原剂:
编号 | A | B | C | D |
氧化剂 | 氯气 | 35%过氧化氢 | 过氧化钠 | 酸性高锰酸钾溶液 |
还原剂 | 镁粉 | 铝粉 | 碳粉 | 锌粉 |
材料5:基本工艺(部分):
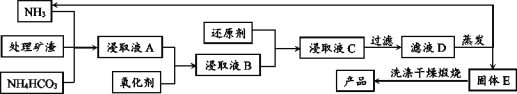
(1)加入氧化剂最好应选择材料4中的_______(填编号);后又加入还原剂的目的是还原溶液中的[Cu(NH3)4]2+、[Pb(NH3)4]2+等离子,请在材料4中选择合适的还原剂写出其中一个离子方程式_______.
(2)对滤液D的蒸发在工艺流程上也叫“蒸氨”,此过程中得到一种碱式盐沉淀物和两种气体,产生的气体可以在经过碱石灰处理后得到纯净而干燥的氨气。固体E经洗涤干燥后,灼烧得到产品,并产生水和CO2。则“蒸氨”过程中发生的化学反应方程式可表述为_______。