题目内容
下列微粒半径大小比较正确的是( )
| A、Na+<Mg2+<Al3+<F- |
| B、Na<Si<S<Cl |
| C、S2->Cl->Mg2+>Al3+ |
| D、Cs<Rb<K<Na |
考点:微粒半径大小的比较
专题:元素周期律与元素周期表专题
分析:核外电子排布相同,核电荷数越大离子半径越小;最外层电子数相同,电子层越多半径越大;电子层数相同,核电荷数越大半径越小,以此来解答.
解答:
解:A.Na+、Mg2+、Al3+、F-都具有相同的电子层结构,核电荷数越大,微粒半径越小,故微粒半径:Al3+<Mg2+<Na+<F-,故A错误;
B.Na、Si、S、Cl的电子层数相同,核电荷数越大,半径越小,即Na>Si>S>Cl,故B错误;
C.核外电子排布相同,核电荷数越大离子半径越小,则S2->Cl->Mg2+>Al3+,故C正确;
D.同主族元素从上到下原子半径逐渐增大,故D错误.
故选C.
B.Na、Si、S、Cl的电子层数相同,核电荷数越大,半径越小,即Na>Si>S>Cl,故B错误;
C.核外电子排布相同,核电荷数越大离子半径越小,则S2->Cl->Mg2+>Al3+,故C正确;
D.同主族元素从上到下原子半径逐渐增大,故D错误.
故选C.
点评:本题考查微粒半径大小比较,为高频考点,侧重于元素周期律的综合考查与运用,难度中等,关键清楚微粒半径大小比较的规律.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
具有相同的质子数和相同电子数的一组微粒是( )
| A、OH-、H2O、F- |
| B、H3O+、NH4+、Na+ |
| C、NH3、NH4+、F- |
| D、Cl-、HS-、S2- |
下列离子能在溶液中大量共存的是( )
| A、K+,NO3-,MnO4-,NH4+ |
| B、Al3+,AlO2-,K+,SO42- |
| C、Mg2+,Cl-,Na+,OH- |
| D、Fe2+,H+,Cl-,NO3- |
下列关于有机物的叙述中正确的是( )
| A、含碳量最高的烃类物质一定是苯 |
| B、相对分子质量相同的不同物质一定是同分异构体 |
| C、液化石油气和天然气的主要成分都是甲烷 |
| D、苯和乙烯都能与H2发生加成反应 |
下列物质中存在分子间作用力的是( )
| A、NaCl |
| B、KOH |
| C、H2O |
| D、SiO2 |
下列化学用语正确的是( )
A、丙烷的分子比例模型示意图: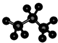 |
B、醛基的电子式: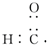 |
C、苯基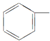 |
| D、乙烯的结构简式CH2CH2 |
下列各项实验的基本操作中,正确的是( )
| A、为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 |
| B、为了分离苯和四氯化碳的混合物,可用分液漏斗分液 |
| C、用碱式滴定管取23.10mL溴水 |
| D、用托盘天平称量11.7g氯化钠晶体 |
下列关于物质或离子的检验操作、结论正确的是( )
| A、用铂丝蘸取某溶液在火焰上灼烧产生黄色火焰,则该溶液中一定含有钠离子,可能含有钾离子 |
| B、向溶液中加入盐酸,有白色沉淀,则溶液中一定含有Ag+ |
| C、能使品红溶液褪色的气体一定是SO2 |
| D、检验氯化亚铁是否变质,加入氢氧化钠,看是否有红褐色沉淀产生 |
常温下能发生反应的一组气体是( )
| A、H2、CO |
| B、CO2、O2 |
| C、NH3、HCl |
| D、N2、O2 |