题目内容
【题目】(1)写出表示含有8个质子,10个中子的原子的化学符号:____________。
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________。
(3)某元素的一种核素的质量数为A,含N个中子,它与1H原子组成HmX分子,在a g HmX中所含质子的物质的量为________mol。
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为![]() ,已知该元素的原子核内质子数和中子数相等,则该元素的名称为________。
,已知该元素的原子核内质子数和中子数相等,则该元素的名称为________。
(5)下列物质中:①氩单质 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2 ⑥金刚石 ⑦H2SO4 ⑧KOH ⑨Na2O2 ⑩K2O
只存在共价键的是_______(填序号);
属于离子化合物,但含有极性共价键的是______(填序号)。
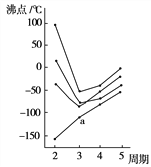
(6)如图所示每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是______
【答案】 ![]() b-n-2
b-n-2 ![]() (A-N+m) 氮 ④⑤⑥⑦ ③⑧ SiH4
(A-N+m) 氮 ④⑤⑥⑦ ③⑧ SiH4
【解析】(1) 含有8个质子,10个中子的原子的化学符号为![]() ,故答案为:
,故答案为: ![]() ;
;
(2)两种离子aX2-和bXn+具有相同的核外电子排布,说明核外电子数相同,则a+2=b-n,整理得a=b-n-2,故答案为:b-n-2;
(3) X的质量数为A,含N个中子,则质子数为A-N,HmX分子中质子数为(A-N+m),其摩尔质量为(A+m)g/mol,则ag HmX的物质的量为![]() =
=![]() mol,含有质子物质的量为
mol,含有质子物质的量为![]() mol×(A-N+m)=
mol×(A-N+m)= ![]() (A-N+m) mol,故答案为:
(A-N+m) mol,故答案为: ![]() (A-N+m);
(A-N+m);
(4)元素R气态氢化合物的化学式RH3,则R的最低负化合价为-3,其最高正化合价为+5,最高价氧化物为R2O5,令R的相对原子质量为a,则2a:80=(1-![]() ):
): ![]() ,解得a=14,元素的原子核中中子数和质子数相等,故该元素质子数为7,故该元素为N元素,故答案为:氮;
,解得a=14,元素的原子核中中子数和质子数相等,故该元素质子数为7,故该元素为N元素,故答案为:氮;
(5) ①氩单质不含共价键;④CH4、⑤CO2、⑦H2SO4中只含极性共价键,属于共价化合物;③NH4Cl ⑧KOH中含有离子键和极性共价键,属于离子化合物;⑨Na2O2中含有离子键和非极性共价键,属于离子化合物;②MgCl2 ⑩K2O中只含离子键,属于离子化合物;⑥金刚石中只含共价键,属于单质;故答案为:④⑤⑥⑦;③⑧;
(6) 在ⅣA~ⅦA中的氢化物里,相对分子质量越大,物质熔沸点越高,NH3、H2O、HF因存在氢键,故沸点高于同主族相邻元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象,故a点代表的应是SiH4,故答案为:SiH4。