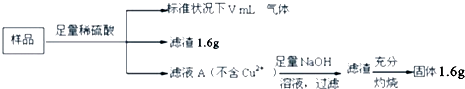
题目内容
【题目】钛被称为继铁、铝之后的第三金属,制备金属钛的一种流程如下:

回答下列问题:
(1)基态钛原子的价电子排布图为___________________,其原子核外共有_____种运动状态不相同的电子。金属钛晶胞如下图2所示,为________________堆积(填堆积方式)。
(2)根据价层电子互斥理论,价层电子对之间的斥力大小有如下顺序:l-l >> l-b > b-b(l为孤对电子对,b为键合电子对),则关于H2O中的H-O-H键角可得出的结论是________。
A.180° B.接近120°,但小于120°
C.接近120°,但大于120° D.接近109°28’,但小于109°28’
(3)已知TiCl4在通常情况下是无色液体,熔点为–37℃,沸点为136℃,可知TiCl4为______晶体。
(4)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如下图1。化合物乙的沸点明显高于化合物甲,主要原因是___________________________。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为__________________。

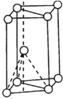
图1 图2
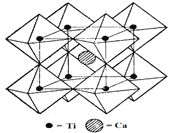
(5)钙钛矿晶体的结构如右图所示。钛离子位于立方晶胞的角顶,被_______个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被__________个氧离子包围。钙钛矿晶体的化学式为_______。若该晶胞的边长为a pm,则钙钛矿晶体的密度为______________g.cm-3(只要求列算式,不必计算出数值)。
【答案】 ![]() 22 六方最密 D 分子 化合物乙分子间形成氢键 N>O>C 6 12 CaTiO3
22 六方最密 D 分子 化合物乙分子间形成氢键 N>O>C 6 12 CaTiO3 ![]()
【解析】(1)钛为22号元素,基态电子排布式为:[Ar]3d24s2,则基态钛原子的价电子排布图为![]() 。基态原子不可能存在运动状态相同的电子,所以Ti有22个不同运动状态的电子。图2的堆积方式对应的是六方最密堆积。
。基态原子不可能存在运动状态相同的电子,所以Ti有22个不同运动状态的电子。图2的堆积方式对应的是六方最密堆积。
(2)H2O中的O原子为sp3杂化,所以∠H-O-H应该接近109°28′,根据价层电子对之间的斥力大小顺序:l-l>>l-b>b-b(l为孤对电子对,b为键合电子对),∠H-O-H的两个电子对都是键合电子对,所以斥力最小,应有∠H-O-H<109°28′,选项D正确,
(3)因TiCl4在常温下是无色液体,熔点、沸点都比较低,由此可判断TiCl4是由共价键结合的分子,晶体类型属于分子晶体。
(4)化合物乙的沸点明显高于化合物甲,主要原因是化合物乙分子间形成氢键。化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为N>O>C,原因是同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第VA族元素大于相邻元素(半满的稳定结构),所以这三种元素第一电离能从大到小顺序是:N>O>C。
(5)根据晶胞结构图可知,在晶胞中氧离子分布在立方体的棱心,被四个立方体共用,所以氧离子数为12×1/4=3,钛离子分布在立方体的八个顶点,每个钛离子被八个立方体所共用,所以钛离子数为8×1/8=1,钙离子分布在立方体的体心,所以钙离子数为1,钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子(12个棱心)包围。据此可以确定化学式为CaTiO3。一个晶胞中有一个CaTiO3,质量为136/NA g。晶胞的体积为(a×10-10)3 cm3,所以密度为![]() g.cm-3。
g.cm-3。