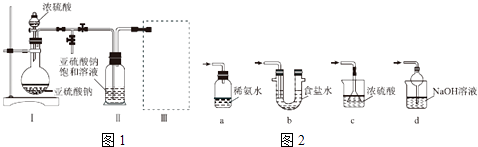
题目内容
【题目】下列说法不正确的是 ( )
A. 碳酸钙受热分解中生成物总能量高于反应物总能量
B. 物质发生化学反应都伴随着原子的变化
C. 化学键的断裂和形成是化学反应中能量变化的根本原因
D. 化学反应必然伴随能量变化
【答案】B
【解析】A. 碳酸钙受热分解是吸热反应,所以生成物总能量高于反应物总能量,A正确;B. 物质发生化学反应,元素的各类和原子的数目不会发生变化,所以B不正确;C. 化学键的断裂要吸收能量,化学键的形成要放出能量,化学反应中能量变化取决于这两者的能量差,所以C正确;D. 化学反应必然伴随能量变化,既不放热也不吸热的化学反应是不存在的,D 正确。本题选B。

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
【题目】已知:下表为25℃时某些弱酸的电离平衡常数.
CH3COOH | HClO | H2CO3 |
Ka=1.8×10﹣5 | Ka=3.0×10﹣8 | Ka1=4.4×10﹣7Ka2=4.7×10﹣11 |
右图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
A.相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O=HClO+CO ![]()
C.图象中a、c两点处的溶液中 ![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D.图象中a点酸的总浓度大于b点酸的总浓度