题目内容
6.常温下,在pH=13的NaOH溶液100mL,要使它的pH降为12,可采取的办法是( )| A. | 加入pH=2盐酸81.8 mL | B. | 加入pH=11的NaOH溶液1000 mL | ||
| C. | 加入pH=3盐酸818.2 mL | D. | 加入1000 mL蒸馏水 |
分析 常温下pH=13的氢氧化钠溶液的浓度为0.1mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,100mL pH=13的氢氧化钠溶液中含有氢氧化钠的物质的量为:0.1mol/L×0.1L=0.01mol,
A.pH=2的盐酸中氢离子浓度为0.01mol/L,先计算出混合液中氢氧化钠的浓度,再计算出溶液pH;
B.pH=11的溶液中氢氧化钠的浓度为0.001mol/L,混合液体积为1.1L,据此计算出混合液中氢氧化钠的浓度;
C.pH=3的盐酸中氢离子浓度为0.001mol/L,计算出混合液中氢氧化钠的浓度,再计算出该溶液的pH;
D.加入1000mL蒸馏水后溶液体积大于1L,则溶液浓度小于0.01mol/L.
解答 解:常温下pH=13的氢氧化钠溶液的浓度为0.1mol/L,pH=12的氢氧化钠溶液的浓度为0.01mol/L,100mL pH=13的氢氧化钠溶液中含有氢氧化钠的物质的量为:0.1mol/L×0.1L=0.01mol,
A.加入pH=2盐酸81.8 mL后,混合液中氢氧化钠的浓度为:$\frac{0.01mol-0.01mol/L×0.0818L}{0.1L+0.0818L}$=$\frac{0.1mol/L×0.9182L}{0.1818L}$≠0.01mol/L,故A错误;
B.加入pH=11的NaOH溶液1000 mL,pH=11的氢氧化钠溶液的浓度为0.001mol/L,则混合液中氢氧化钠的浓度为:$\frac{0.01mol+0.001mol×1L}{0.1L+1L}$=0.01mol/L,所得溶液的pH=12,故B正确;
C.pH=3的溶液中氢离子浓度为0.001mol/L,则混合液中氢氧根离子的浓度为:$\frac{0.01mol-0.001mol/L×0.8182L}{0.1L+0.8182L}$=$\frac{0.01mol/L×(1-0.08182)L}{0.9182L}$=0.01mol/L,所得溶液的pH=12,故C正确;
D.加入1000mL蒸馏水后溶液体积约为1.1L,稀释后溶液中氢氧化钠浓度为:$\frac{0.01mol}{1.1L}$<0.01mol/L,不满足条件,故D错误;
故选BC.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系及计算方法为解答关键,试题培养了学生的分析能力及灵活应用能力.

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案| A. | Ba(OH)2溶液滴入稀硫酸中 | B. | 氢氧化钠溶液和稀硝酸反应 | ||
| C. | 氢氧化镁和稀盐酸反应 | D. | NaOH溶液滴入醋酸中 |
| A. | NaOH溶液中混有Ba(OH)2 (K2SO4溶液) | B. | O2中混有H2(灼热的氧化铜) | ||
| C. | CO2中混有HCl气体 (NaOH溶液) | D. | Cu粉中混有Al粉(稀盐酸) |
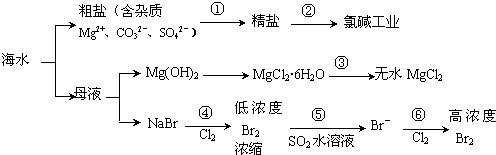
| A. | 过程①的提纯是物理过程,过程②通过氧化还原反应可产生2种单质 | |
| B. | 除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| C. | 在过程③中将MgCl2•6H2O灼烧即可制得无水MgCl2 | |
| D. | 在过程④、⑥反应中每氧化0.2 mol Br-需消耗0.1mol Cl2 |
| A. | 纯碱溶液可去除油污 | |
| B. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 | |
| C. | TiCl4溶于大量水加热制备TiO2 | |
| D. | 保存FeSO4溶液时加入少量铁粉 |
| A. | FeO溶于稀HNO3中 3FeO+10H++NO${\;}_{3}^{-}$═3Fe3++NO↑+5H2O | |
| B. | NH4HSO4溶液与少量的NaOH稀溶液的反应:NH4++H++2OH-═H2O+NH3•H2O | |
| C. | Ba(OH)2溶液与NaHSO4溶液的反应溶液呈中性:Ba2++OH-+H++SO${\;}_{4}^{2-}$═BaSO4↓+H2O | |
| D. | 0.01 mol•L-1 NH4Al(SO4)2溶液与0.02 mol•L-1 Ba(OH)2溶液等体积混合:Al3++2Ba2++4OH-+2SO${\;}_{4}^{2-}$═2BaSO4↓+AlO${\;}_{2}^{-}$+2H2O |
| A | B | C | D | |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 | 增加O2浓度对反应平衡的影响 | 浓度对平衡常数的影响 |
| 图示 |  | 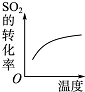 |  |  |
| A. | A | B. | B | C. | C | D. | D |

 电化学在工业生产中有广泛应用.
电化学在工业生产中有广泛应用.