题目内容
将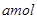 Na2O2和
Na2O2和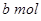 NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,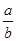 值可能为
值可能为
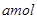 Na2O2和
Na2O2和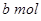 NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,
NaHCO3固体混合后,在密闭容器中加热到250℃,让其充分反应。当剩余固体为Na2CO3,排出气体为O2、H2O时,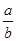 值可能为
值可能为| A.0.5 | B.0.65 | C.0.85 | D.1.0 |
D
试题分析:混合物在密闭容器中加热到250℃时,可能发生如下反应:
①2NaHCO3
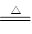 Na2CO3 + CO2↑+ H2O②2Na2O2+2CO2=2Na2CO3+O2
Na2CO3 + CO2↑+ H2O②2Na2O2+2CO2=2Na2CO3+O2③2Na2O2+2H2O=4NaOH+O2 ④2NaOH+CO2=Na2CO3+H2O依题意可知,残余的固体为Na2CO3,生成的气体为O2和H2O(g),只发生反应①和②,a:b=1,选D。

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
 测定剩余固体质量
测定剩余固体质量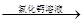 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量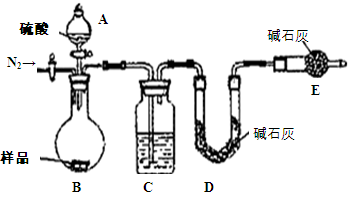
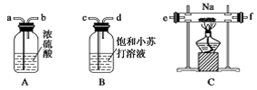
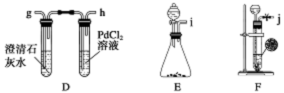
 变灰暗
变灰暗 变白色
变白色 出现液滴
出现液滴 白色固体,
白色固体,