题目内容
下列几种情况,对中和滴定结果无影响的是
| A.滴定管用水冲洗后即注入标准液 | B.锥形瓶里有少量水 |
| C.滴定前标准液在“0”刻度以上 | D.滴定管尖端未充满液体 |
B
试题分析:根据c(待)=
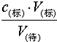 判断不当操作对相关物理量的影响。A、滴定管用水冲洗后即注入标准液,则标准液浓度降低,造成V(标)偏大,根据c(待)=
判断不当操作对相关物理量的影响。A、滴定管用水冲洗后即注入标准液,则标准液浓度降低,造成V(标)偏大,根据c(待)=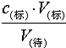 可知测定结果偏高,A不正确;B、盛待测液的锥形瓶里留有蒸馏水,对V(标)无影响,根据c(待)=
可知测定结果偏高,A不正确;B、盛待测液的锥形瓶里留有蒸馏水,对V(标)无影响,根据c(待)=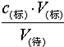 可知,c(待)不变,故B正确;C、滴定前标准液在“0”刻度以上,则造成V(标)偏小,根据c(待)=
可知,c(待)不变,故B正确;C、滴定前标准液在“0”刻度以上,则造成V(标)偏小,根据c(待)=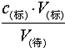 可知,c(待)偏小,C不正确;D、滴定管尖端未充满液体,造成V(标)偏大,根据c(待)=
可知,c(待)偏小,C不正确;D、滴定管尖端未充满液体,造成V(标)偏大,根据c(待)=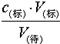 可知,c(待)偏大,D不正确,答案选B。
可知,c(待)偏大,D不正确,答案选B。
练习册系列答案
相关题目
 Na2S2O3,
Na2S2O3,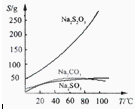
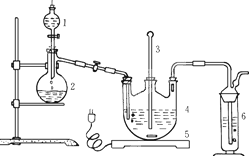
 6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,
6I-+Cr2O72-+14H+=3I2+2Cr3++7H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应: I2+2S2O32-=2I-+S4O62-,滴定终点的现象为 ,