题目内容
钾水玻璃以其优异的性能广泛用于防腐、铸造、油田、钻井或各种高档涂料中。钾水玻璃中硅含量的测定可以采用氟硅酸钾容量法,其步骤为:
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
①称取试样溶解在含有过量的氟离子和钾离子的强酸溶液中,硅能与氟离子、钾离子作用生成氟硅酸钾(K2SiF6)沉淀;
②沉淀分离后于热水中水解,生成HF、H2SiO3、KF;
③过滤除去硅酸沉淀,用氢氧化钠标准溶液滴定滤液。
(1)上述步骤②中的水解反应方程式为 ;步骤③中反应的离子方程式为: 。
(2)在步骤③中,若滴定前未用氢氧化钠标准溶液润洗滴定管,则测得的硅元素含量将 (填“偏高”、或“偏低”或“不变”)。
(3)若每次称取试样的质量为1.00g,重复滴定四次,消耗1.00 mol·L-1氢氧化钠标准溶液的体积为分别为16.80mL、19.90mL、20.00mL、20.10mL,试计算该试样中硅元素的质量分数(以二氧化硅计),写出计算过程。
(1)K2SiF6+3H2O=2KF+H2SiO3+4HF(2分) HF+OH—=F—+H2O (2分)
(2)偏高(2分)
(3)由题中数据可得出消耗氢氧化钠标准溶液体积的平均值为20.00ml(2分)
关系式:SiO2~Si~4HF~4NaOH
60g 4mol
m(SiO2) 20.00×10—3L×1.0mol·L-1
求得m(SiO2)=0.30g(2分)
硅元素的质量分数(以二氧化硅计):
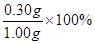 =30%(2分)
=30%(2分)试题分析:(1)过滤除去硅酸沉淀,溶液中HF与氢氧化钠溶液反应;(2)若滴定前未用氢氧化钠标准溶液润洗滴定管,导致滴定管中氢氧化钠溶液浓度降低,滴定相同量HF消耗的体积增大,故测得的硅元素含量将偏高;(3)剔除偏差较大的读数(16.80),平均体积为20.00mL,根据关系式计算可得。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目