题目内容
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1 mol/L,下面四个选项中能达到此目的的是
| A.Ca2+、K+、OH?、Cl?、NO3? |
| B.Fe2+、H+、Br?、NO3?、Cl? |
| C.Na+、K+、SO42?、NO3?、Cl? |
| D.Al3+、Na+、Cl?、SO42?、NO3? |
D
解析试题分析:A、Ca2+与OH?形成微溶物Ca(OH)2,错误;B、H+、NO3?把Fe2+氧化,错误;C、电荷不守恒,负电荷多,错误;D、电荷守恒,离子共存,正确。
考点:考查离子共存等相关知识。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列微粒在溶液中能大量共存,通入NH3仍能大量共存的一组是
| A.Na+ Mg2+ Cl- NO3- | B.K+ CH3COOH Br- SO42- |
| C.Na+ K+ OH- CO32- | D.K+Ag+ NH4+NO3- |
下列离子方程式与所述事实相符且正确的是( )
| A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+H2O |
| B.明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=A1O2-+2BaSO4+2H2O |
| C.向硫酸铝溶液中加入过量氨水:Al3++4NH3·H2O=A1O2-+4NH4++2H2O |
| D.磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-=3Fe3++NO↑+4H2O |
室温时,在指定溶液中能大量共存的一组离子或分子是
| A.使pH试纸显深红色的溶液:NH4+、Mg2+、Cl-、NO3- |
| B.能使淀粉碘化钾试纸显蓝色的溶液:NH4+、Cu2+、S2-、SO42- |
| C.0.1mol·L-1碱溶液:Al3+、Fe3+、SO42-、Cl2 |
| D.由水电离的c(H+)=10-12mol/L的溶液:K+、Na+、SiO32-、HCO3- |
某溶液中除H+、OH— 外,还有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量之比为1:1:6,下列有关该溶液的判断正确的是
| A.向该溶液中加入稀NaOH溶液,立即产生白色沉淀 |
| B.向该溶液中加入KI溶液后,原有五种离子的物质的量不变 |
| C.若溶液中c (Cl?)=0.6mol/L,则该溶液的pH为1 |
| D.向该溶液中加入过量铁粉,只能发生置换反应 |
下列离子方程式中正确的是
| A.NH4HCO3溶液与过量NaOH溶液反应:NH4+ + OH- → NH3↑+2H2O |
| B.向FeBr2溶液中通入Cl2,当n(FeBr2)=n(Cl2)时:2Fe2++4Br-+3Cl2→2Fe3++2Br2+6Cl- |
| C.向FeI2溶液中通入Cl2,当n(FeI2):n(Cl2)=1:1时: 2I-+Cl2→I2+2Cl- |
| D.向烧碱溶液中通入CO2,当n(NaOH):n(CO2)=3:2时: OH-+CO2→HCO3- |
下列物质仅能在水溶液中导电的是
| A.HCl | B.NaHSO3 | C.NaOH | D.CH3CH2OH |
已知同温度下溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2++2HCO3-+2Ca2++4OH- = Mg(OH)2↓+2CaCO3↓+2H2O |
| B.Cu2++H2S = CuS↓+2H+ |
| C.Zn2++S2-+2H2O = Zn(OH)2↓+H2S↑ |
| D.FeS+2H+ = Fe2++H2 S↑ |
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种。取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示。下列判断正确的是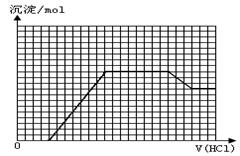
| A.原溶液中可能含有NH4+、SO42- |
| B.最终溶液中最少含2种溶质 |
| C.原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D.滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |