题目内容
某无色溶液M可能含有离子OH-、HCO3-、CO32-、SO42-、SiO32-、AlO2-、NH4+、MnO4-、Cu2+、Mg2+、Na+、Fe3+中的若干种。取一定量的M溶液滴加盐酸,产生沉淀的物质的量与盐酸体积的关系如图所示。下列判断正确的是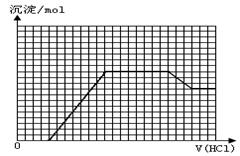
| A.原溶液中可能含有NH4+、SO42- |
| B.最终溶液中最少含2种溶质 |
| C.原溶液中n(NaAlO2):n(Na2CO3)=1:1 |
| D.滴加盐酸初始阶段发生反应的离子方程式是:CO32-+H+=HCO3- |
B
解析试题分析:无色溶液首先排除MnO4-、Cu2+ 、Fe3+,根据图像,刚开始滴加盐酸无沉淀,说明有OH-,也就没有HCO3-、Mg2+、 NH4+,继续滴加盐酸有沉淀产生,但是沉淀增加到一定值时不再变化,一段时间后减少,说明一定有AlO2-、SiO32-、CO32-,根据电荷守恒,Na+一定有,SO42-可能有,A错误;B正确;
C、n(NaAlO2)与n(Na2CO3)的比值和消耗盐酸体积有关系,看沉淀溶解,消耗盐酸体积为3格,是AlO2-转换为Al(OH)3,与盐酸反应;中间沉淀不变消耗盐酸体积为8格,是CO32-与盐酸反应生成CO2,则比值为3:4,错误;D、开始时是OH-和H+反应生成水,错误。
考点:考查离子共存、化合物性质以及物质的量计算

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案
相关题目
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1 mol/L,下面四个选项中能达到此目的的是
| A.Ca2+、K+、OH?、Cl?、NO3? |
| B.Fe2+、H+、Br?、NO3?、Cl? |
| C.Na+、K+、SO42?、NO3?、Cl? |
| D.Al3+、Na+、Cl?、SO42?、NO3? |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.能溶液Al2O3的溶液:Na+、K+、HCO—3、NO—3 |
| B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I—、Cl— |
| C.能使甲基橙显红色的溶液:K+、Fe2+、Cl—、NO—3 |
| D.加入KSCN显红色的溶液:Na+、Mg2+、Cl—、SO2—4 |
下列有关离子的各种说法中,正确的是
| A.金属钠溶于足量水中的离子方程式:Na+2H2O=Na++H2↑+2OH- |
| B.加入铝粉后产生大量氢气的溶液中:NH4+、Na+、NO3-、Cl-可以大量共存 |
| C.等物质的量浓度、等体积的氨水与盐酸混和,溶液中离子浓度关系为 c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| D.等物质的量的二元弱酸H2X与其钾盐K2X的混合溶液中c(K+)=c(H2X)+c(HX-)+c(X2-) |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.01 mol·L-1Ba(OH)2溶液:Al3+、NH4+、NO3-、HCO3- |
| B.加入甲基橙显红色的溶液:Mg2+、Fe2+、Cl-、NO3- |
| C.含有苯酚的溶液中:K+、NH4+、Br-、Fe3+ |
| D.0.01mol·L-1HCl溶液:K+、Na+、I-、SO42- |
下列表示对应化学反应的离子方程式正确的是
| A.澄清石灰水中滴加少量的小苏打溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
| B.醋酸溶液和大理石中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C.NH4Al (SO4)2溶液中滴加少量的NaOH溶液:NH4++OH-=NH3·H2O |
| D.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH-=AlO2-+2H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.0.1 mol·L-1 KNO3溶液:Mg2+、Fe2+、Cl-、SO42- |
| B.无色透明的溶液:Cu2+、NH4+、NO3-、CO32- |
| C.使pH试纸变红的溶液:K+、Ca2+、Cl-、ClO- |
| D.水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、NH4+、SO42-、NO3- |
下列离子方程式正确的是
| A.向CuSO4溶液中投入Na:Cu2++2Na=Cu+2Na+ |
| B.向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓ |
| C.向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D.向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+=Ba2++CO2↑+H2O |