ΧβΡΩΡΎ»ί
œ÷”–FeΓΔCuΉι≥…ΒΡΚœΫπΘ§Τδ÷–FeΓΔCuΒΡΉήΈο÷ ΒΡΝΩΈΣa molΘ§CuΒΡΈο÷ ΒΡΝΩΖ÷ ΐΈΣxΓΘΫΪΚœΫπ―–≥…ΖέΡ©ΚσΘ§»Ϊ≤ΩΆΕ»κΒΫΚ§b mol HNO3ΒΡœΓ»ή“Κ÷–Θ§ΈΔ»» ΙΤδ≥δΖ÷Ζ¥”ΠΘ§«“œθΥαΒΡΜΙ‘≠≤ζΈο÷Μ”–NOΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚΘ®1Θ©”ΟΝΘΉ”ΖϊΚ≈Χν–¥œ¬Ν–Ω’ΑΉΘ®Ν–ΨΌ≥ω»Ϊ≤ΩΩ…ΡήΒΡ«ιΩωΘ©
|
|
ΔΌ |
ΔΎ |
Δέ |
Δή |
Γ≠ |
|
≤–ΝτΙΧΧε≥…Ζ÷ |
|
|
|
|
|
|
»ή“Κ÷–ΒΡΫπ τάκΉ” |
|
|
|
|
|
ΔΤΒ±»ή“Κ÷–Ϋπ τάκΉ”÷Μ”–Fe2+ΚΆCu2+ ±Θ§‘ρbΒΡ»Γ÷ΒΖΕΈß «ΓΓΓΓΓΓΓΓ ___ Θ®”ΟaΓΔx±μ ΨΘ©ΓΘ
Δ«Β±x=0.5 ±Θ§»ή“Κ÷–Fe2+”κFe3+ΒΡΈο÷ ΒΡΝΩœύΒ» ±Θ§‘Ύ±ξΉΦΉ¥Ωωœ¬Ι≤≤ζ…ζ672 mLΤχΧεΓΘ«σaΓΔbΒΡ÷ΒΓΘ
ΫβΈωΘΚ
Δ≈
ΔΤ Δ«a=0.04 molΘ§b=0.12 mol
|
Χα ΨΘΚ
Θ®1Θ©
ΔΤ3Cu + 8HNO3=3Cu(NO3)2+2NOΓϋ+4H2O ax 3Fe + 8HNO3 = 3Fe(NO3)2+2NOΓϋ+4H2O a(1-x)
œϊΚΡœθΥαΉήΝΩn(H
Δ«ΗυΨίΒγΉ” ΊΚψΒΟΘΚ0.5aΓΝ2+0.25aΓΝ3+0.25aΓΝ2= ”÷÷ΣΘΚ3Cu ΓΪ 8HNO3 3Fe ΓΪ 8HNO3 Fe ΓΪ 4HNO3(…ζ≥…Fe3+) b=
|

(1)”ΟΝΘΉ”ΖϊΚ≈Χν–¥œ¬Ν–Ω’ΑΉ(Ν–ΨΌ≥ω»Ϊ≤ΩΩ…ΡήΒΡ«ιΩω)
| ΔΌ | ΔΎ | Δέ | Δή | Γ≠ |
≤–ΝτΙΧΧε≥…Ζ÷ |
|
|
|
|
|
»ή“Κ÷–ΒΡΫπ τάκΉ” |
|
|
|
|
|
(2)Β±»ή“Κ÷–Ϋπ τάκΉ”÷Μ”–Fe2+ΚΆCu2+ ±Θ§‘ρbΒΡ»Γ÷ΒΖΕΈß «__________________(”ΟaΓΔx±μ Ψ)ΓΘ
(3)Β±x=0.5Θ§»ή“Κ÷–Fe3+”κFe2+ΒΡΈο÷ ΒΡΝΩœύΒ» ±Θ§‘Ύ±ξΉΦΉ¥Ωωœ¬Ι≤≤ζ…ζ672 mLΤχΧεΓΘ«σaΓΔbΒΡ÷ΒΓΘ
(1)ΥφHNO3”ΟΝΩΒΡ‘ωΦ”Θ§»ή“Κ÷–ΒΡΫπ τάκΉ”ΚΆ≤–ΝτΙΧΧεΒΡ≥…Ζ÷“ά¥Έ”–Νυ÷÷«ιΩωΘ§«κ”ΟΝΘΉ”ΖϊΚ≈Χν–¥œ¬Ν–Ω’ΑΉΘΚ
| ΔΌ | ΔΎ | Δέ | Δή | Δί | Δό |
»ή“Κ÷–ΒΡΫπ τάκΉ” |
| Fe2+ |
| Fe2+ Cu2+ |
| Cu2+ Fe3+ |
≤–ΝτΙΧΧε≥…Ζ÷ | Fe Cu |
| Cu | ΓΣ | ΓΣ | ΓΣ |
(2)Β±»ή“Κ÷–Ϋπ τάκΉ”÷Μ”–Fe2+ΓΔCu2+ ±Θ§«σbΒΡ»Γ÷ΒΖΕΈßΓΘ?
œ÷”–FeΓΔCuΉι≥…ΒΡΚœΫπΘ§Τδ÷–CuΓΔFeΒΡΉήΈο÷ ΒΡΝΩΈΣamolΘ§CuΒΡΈο÷ ΒΡΝΩΖ÷ ΐΈΣxΘΜ―–≥…ΖέΡ©ΚσΘ§»Ϊ≤ΩΆΕ»κΚ§bmol HNO3ΒΡœΓ»ή“Κ÷–Θ§ΈΔ»» ΙΤδ≥δΖ÷Ζ¥”ΠΘ§«“œθΥαΒΡΜΙ‘≠≤ζΈο÷Μ”–NOΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ(“―÷ΣΘΚCu+2Fe3+=2Fe2++Cu2+)
Θ®1Θ©ΥφHNO3”ΟΝΩΒΡ‘ωΦ”Θ§»ή“Κ÷–ΒΡΫπ τάκΉ”ΚΆ≤–ΝτΙΧΧεΒΡ≥…Ζ÷“ά¥Έ”–Νυ÷÷«ιΩωΘ§«κ”ΟΝΘΉ”ΖϊΚ≈Χν–¥œ¬Ν–Ω’ΑΉΘΚ
| ΔΌ | ΔΎ | Δέ | Δή | Δί | Δό |
»ή“Κ÷–ΒΡΫπ τάκΉ” |
| Fe2+ |
| Fe2+ΓΔCu2+ |
| Cu2+ΓΔFe3+ |
≤–ΝτΙΧΧε≥…Ζ÷ | FeΓΔCu |
| Cu | ®D®D | ®D®D | ®D®D |
Θ®2Θ©Β±»ή“Κ÷–Ϋπ τάκΉ”÷Μ”–Fe2+ΓΔCu2+ ±Θ§«σbΒΡ»Γ÷ΒΖΕΈßΓΘ
Θ®3Θ©Β±x=0.5 ±Θ§»ή“Κ÷–Fe3+”κFe2+ΒΡΈο÷ ΒΡΝΩœύΒ» ±Θ§‘Ύ±ξΉΦΉ¥ΩωΙ≤≤ζ…ζ672mLΤχΧεΓΘ«σaΓΔbΒΡ÷ΒΓΘ
 ΒΡœΓ»ή“Κ÷–Θ§ΈΔ»» ΙΤδ≥δΖ÷Ζ¥”ΠΘ§«“œθΥαΒΡΜΙ‘≠≤ζΈο÷Μ”–NOΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
ΒΡœΓ»ή“Κ÷–Θ§ΈΔ»» ΙΤδ≥δΖ÷Ζ¥”ΠΘ§«“œθΥαΒΡΜΙ‘≠≤ζΈο÷Μ”–NOΘ§ ‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ ΓΔCu
ΓΔCu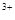 ”κFe
”κFe