题目内容
现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a,Cu的物质的量分数为x。将合金研成粉末后,全部投入到含b HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO。试回答下列问题:(1)用粒子符号填写下列空白(列举出全部可能的情况)
| ① | ② | ③ | ④ | … |
残留固体成分 |
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+和Cu2+时,则b的取值范围是__________________(用a、x表示)。
(3)当x=0.5,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生672 mL气体。求a、b的值。
解析:(1)
① | ② | ③ | ④ | ⑤ | ⑥ |
FeCu | Cu | Cu |
|
|
|
Fe2+ | Fe2+ | Fe2+ Cu2+ | Fe2+ Cu2+ | Fe2+ Fe3+ Cu2+ | Fe2+ Fe3+ |
(2)3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
ax ![]()
3Fe + 8HNO3===3Fe(NO3)2+2NO↑+4H2O
a(1-x) ![]()
消耗硝酸总量n(HNO3)=![]() +
+![]() =
=![]() ,
,
![]() <b≤
<b≤![]() 。
。
(3)根据电子守恒得:
0.5a×2+0.25a×3+0.25a×2=![]() ×3
×3
a=0.04 mol
又知:3Cu&8HNO3,3Fe&8HNO3,Fe&4HNO3(生成Fe3+)
b=![]() mol+
mol+![]() mol+0.04 mol=0.12 mol。
mol+0.04 mol=0.12 mol。
答案:(1)
① | ② | ③ | ④ | ⑤ | ⑥ |
FeCu | Cu | Cu |
|
|
|
Fe2+ | Fe2+ | Fe2+ Cu2+ | Fe2+ Cu2+ | Fe2+ Fe3+ Cu2+ | Fe2+ Fe3+ |
(2)![]() <b≤
<b≤![]()
(3)a=0.04 mol,b=0.12 mol

(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ |
溶液中的金属离子 |
| Fe2+ |
| Fe2+ Cu2+ |
| Cu2+ Fe3+ |
残留固体成分 | Fe Cu |
| Cu | — | — | — |
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围。?
现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为amol,Cu的物质的量分数为x;研成粉末后,全部投入含bmol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:(已知:Cu+2Fe3+=2Fe2++Cu2+)
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ |
溶液中的金属离子 |
| Fe2+ |
| Fe2+、Cu2+ |
| Cu2+、Fe3+ |
残留固体成分 | Fe、Cu |
| Cu | ―― | ―― | ―― |
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围。
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况共产生672mL气体。求a、b的值。
 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题: 、Cu
、Cu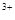 与Fe
与Fe