��Ŀ����
����Fe��Cu��ɵĺϽ�����Cu��Fe�������ʵ���Ϊamol��Cu�����ʵ�������Ϊx���гɷ�ĩ��ȫ��Ͷ�뺬bmol HNO3��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺(��֪��Cu+2Fe3+=2Fe2++Cu2+)
��1����HNO3���������ӣ���Һ�еĽ������ӺͲ�������ijɷ�����������������������ӷ�����д���пհף�
| �� | �� | �� | �� | �� | �� |
��Һ�еĽ������� |
| Fe2+ |
| Fe2+��Cu2+ |
| Cu2+��Fe3+ |
��������ɷ� | Fe��Cu |
| Cu | �D�D | �D�D | �D�D |
��2������Һ�н�������ֻ��Fe2+��Cu2+ʱ����b��ȡֵ��Χ��
��3����x=0.5ʱ����Һ��Fe3+��Fe2+�����ʵ������ʱ���ڱ�״��������672mL���塣��a��b��ֵ��
(1)
| �� | �� | �� | �� | �� | �� |
��Һ�еĽ������� | Fe2+ |
| Fe2+��Cu2+ |
| Fe2+��Cu2+��Fe3+ |
|
��������ɷ� |
| Cu |
| �D�D | �D�D | �D�D |
(2) 3Cu + 8HNO3=3Cu(NO3)2+2NO��+4H2O
ax ![]()
3Fe + 8HNO3 = 3Fe(NO3)3 + 2NO�� + 4H2O
a(1��x) ![]()
�ܺ����������� n(HNO3)2=![]() +
+![]() =
=![]()
���ԣ�![]() <b��
<b��![]()
(3) 0.5a��2ʮ0.25a��2+0.25a��3=0.672L��22.4L?mol�D1��3
a=0.04mol
b=0.5a��2+0.25a��2+0.25a��3+0.672L��22.4L?mol�D1=2.25a+0.03mo1
=2.25��0.04mol+0.03mol=0.12mol

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�(1)�����ӷ�����д���пհ�(�оٳ�ȫ�����ܵ����)
| �� | �� | �� | �� | �� |
��������ɷ� |
|
|
|
|
|
��Һ�еĽ������� |
|
|
|
|
|
(2)����Һ�н�������ֻ��Fe2+��Cu2+ʱ����b��ȡֵ��Χ��__________________(��a��x��ʾ)��
(3)��x=0.5����Һ��Fe3+��Fe2+�����ʵ������ʱ���ڱ�״���¹�����672 mL���塣��a��b��ֵ��
(1)��HNO3���������ӣ���Һ�еĽ������ӺͲ�������ijɷ�����������������������ӷ�����д���пհף�
| �� | �� | �� | �� | �� | �� |
��Һ�еĽ������� |
| Fe2+ |
| Fe2+ Cu2+ |
| Cu2+ Fe3+ |
��������ɷ� | Fe Cu |
| Cu | �� | �� | �� |
(2)����Һ�н�������ֻ��Fe2+��Cu2+ʱ����b��ȡֵ��Χ��?
 ��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺
��ϡ��Һ�У���ʹ���ַ�Ӧ��������Ļ�ԭ����ֻ��NO���Իش��������⣺ ��Cu
��Cu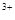 ��Fe
��Fe