题目内容
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题: 
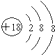
(1)画出⑦的原子结构示意图 .
(2)写出②含有10个中子的核素的化学符号 .
(3)已知元素的非金属性:②<③,则氢化物的稳定性由强到弱的顺序为(填化学式).
(4)请写出①的氢化物发生催化氧化的化学方程式 .
(5)表中能形成两性氢氧化物的元素是(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式 .
【答案】
(1)
(2)818O
(3)HF>H2O
(4)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(5)Al;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
【解析】解:由元素的位置可知,①~⑧分别为N、O、F、Na、Al、S、Ar、K,(1)Ar的原子结构中有3个电子层,最外层电子数为8,原子结构示意图为 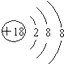 ,所以答案是:
,所以答案是: 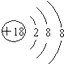 ;(2)②含有10个中子的核素,质量数为18,化学符号为818O,所以答案是:818O;(3)非金属性越强,气态氢化物越稳定,氢化物的稳定性由强到弱的顺序为HF>H2O,所以答案是:HF>H2O;(4)氨气催化氧化生成NO和水,化学反应为4NH3+5O2
;(2)②含有10个中子的核素,质量数为18,化学符号为818O,所以答案是:818O;(3)非金属性越强,气态氢化物越稳定,氢化物的稳定性由强到弱的顺序为HF>H2O,所以答案是:HF>H2O;(4)氨气催化氧化生成NO和水,化学反应为4NH3+5O2 ![]() 4NO+6H2O,所以答案是:4NH3+5O2
4NO+6H2O,所以答案是:4NH3+5O2 ![]() 4NO+6H2O;(5)Al的氢氧化物具有两性,Al与KOH反应生成偏铝酸钾和氢气,离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:Al;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑.
4NO+6H2O;(5)Al的氢氧化物具有两性,Al与KOH反应生成偏铝酸钾和氢气,离子反应为2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,所以答案是:Al;2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目

