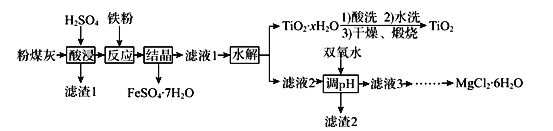
题目内容
【题目】25℃时,向H2CO3溶液中滴入NaOH溶液,溶液中H2CO3、HCO3-及CO32-的物质的量分数δ(X)随溶液pH的变化如图所示{δ(X)=[c(X)/c(H2CO3)+c(HCO3-)+c(CO32-)]×100%}。
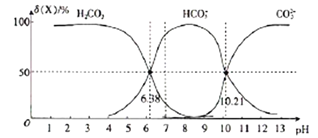
下列说法错误的是
A. H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38
B. pH=13时,c(Na+)十c(H+)=c(OH-)+2c(CO32-)
C. 25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数对数值1gK=-3.79
HCO3-+OH-的平衡常数对数值1gK=-3.79
D. pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-)
【答案】B
【解析】A.由图像可知,pH=6.38时,c(H+)=10-6.38mol/L,c(H2CO3)= c(HCO3-) ,所以,H2CO3的一级电离平衡常数的对数值lgK1(H2CO3)=-6.38,A正确;B. pH=13时,由电荷守恒可知,c(Na+)十c(H+)=c(OH-)+ c(HCO3-)+2c(CO32-),B不正确;C. 由图可知,pH=10.21时,c(H+)=10-10.21mol/L,c(CO32-)= c(HCO3-) ,所以K2(H2CO3)= 10-10.21,因此,25℃时,反应CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=![]() =10-3.79,其对数值1gK=-3.79,C正确;D. 由图中信息可知,pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-),D正确。本题选B。
=10-3.79,其对数值1gK=-3.79,C正确;D. 由图中信息可知,pH=7时,c(HCO3-)>c(H2CO3)> c(CO32-),D正确。本题选B。

 阅读快车系列答案
阅读快车系列答案【题目】常见的分类法有交叉分类法、树状分类法等。无机化合物可根据其组成和性质进行分类:
(1)上图所示的物质分类方法名称是_______________________。
(2)以Na、H、O、N、C中两种或三种元素组成合适的物质,分别填在下表①④⑦处。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ① _________②HNO3 | ③NH3H2O ④________ | ⑤Na2CO3 ⑥NaNO3 ⑦_______ | ⑧CO2 ⑨Na2O2 |
(3)在②③⑤⑥⑧⑨六种物质中,属于非电解质的是______________(填序号)。
(4)过量⑧通入④中发生反应的离子方程式为:______________________________________________。⑧与⑨反应的化学方程式为:______________________________。
(5)15.9g⑤溶于水配制成250mL溶液,CO32-的粒子数为__________,Na+的物质的量浓度为________。