题目内容
海水资源的开发和利用是当前科学研究的一项重要任务。下图是实验室模拟镁开发的流程图:
根据上述流程图,回答下列问题:
(1)操作I的名称是 。
(2)步骤中②反应的化学方程式为 。
(3)步骤④中加热时通入HCl气流的作用是 。
(4)步骤⑤的离子反应方程式为 。
(5)有人提出步骤⑤的副产物可在流程中再利用以提高海水的综合利用率。若A为上述流程中的某组分,则A、B分别为 。
(1)过滤(1分)
(2)CaO+H2O=Ca(OH)2(1分) MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(MgBr2也可是MgCl2、MgSO4等) (1分)
(3)增大HCl浓度抑制MgCl2的水解(1分)
(4)Mg2++2Cl- Mg+Cl2↑(2分)
Mg+Cl2↑(2分)
(5)滤液(或浓缩液) Br2(2分,各1分)
解析试题分析:
海水中主要有Na+,Cl-,Mg2+,Br-,SO42-等离子,蒸发浓缩后取浓缩液加CaO后会产生Mg(OH)2↓,进行过滤,滤液中当然含有Na+,Cl-,Br-,SO42-等离子。取所得的Mg(OH)2加HCl后进行浓缩结晶得到MgCl2晶体。再在HCl氛围中加热使其失去结晶水,得到MgCl2后,在进行电解得到Mg和Cl2。
(1)将固体和液体分开采用过滤(2)步骤中②反应的化学方程式为CaO+H2O=Ca(OH)2 MgBr2+ Ca(OH)2= Mg(OH)2↓+CaBr2(3)步骤④中加热时通入HCl增大HCl浓度,在HCl氛围中,抑制MgCl2的水解,不能直接加热,否则MgCl2晶体会发生水解得到Mg(OH)2(4)步骤⑤的离子反应方程式为Mg2++2Cl- Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2
Mg+Cl2,电解方程式,在熔融状态下MgCl2会电离出离子,所以要拆成离子形式。(5)上述流程中除了Mg,还能与Cl2反应的只有Br-,存在于溶液中,通过Cl2置换,可以回收利用Br2
考点:物质的分离与提纯(水解,离子方程式书写,实验操作等)

发酵粉是一种化学膨松剂,可由小苏打、臭粉(碳酸氢铵)、明矾[KAl(SO4)2?12H2O]中的两种物质组成。某小组为探究不同品牌的发酵粉的化学成分,进行如下实验。
【提出假设】
(1)假设1:由小苏打和臭粉组成
假设2:由小苏打和明矾组成
假设3:由__________________________组成
【方案与流程】
为探究甲品牌的发酵粉的成分,某同学设计如下实验,得到如下现象:
(2)结合步骤①~③分析,气体A为________,该发酵粉的成分为__________________。
(3)若步骤①和②操作不变(现象也相同),将步骤③中足量稀盐酸改为足量氯化钡溶液,观察到有白色沉淀生成,能否确定发酵粉的成分并说明理由:________________, ____________________________________________________________________。
(4)乙品牌的发酵粉的化学组成可能为假设2情况,请设计实验验证。
实验仪器和用品任选,限选试剂:稀盐酸、0.1 mol/LNaOH溶液,写出实验步骤、预期现象和结论。
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量样品溶于足量的盐酸后, 将溶液分成两份,分别装入A、B试管中。 | |
| 步骤2:_____________________________ __________________________________ | ________________________证明有Na+,发 酵粉中有NaHCO3。 |
| 步骤3:_____________________________ ___________________________________ | ___________________________________ _______,结合步骤2中的结论,假设2成立。 |
下图是产生和收集气体的实验装置,该装置适合于
| A.用H2O2溶液和MnO2反应制取O2 |
| B.用浓盐酸和MnO2反应制取C12 |
| C.用稀硫酸与石灰石反应制取CO2 |
| D.用NH4C1和Ca(OH)2反应制取NH3 |
利用下列各组中的物质制备并收集相应的气体,能采用如图所示装置的是
| A.浓氨水和固体NaOH制NH3 |
| B.过氧化氢溶液和二氧化锰制O2 |
| C.稀硝酸和铜片制NO |
| D.电石和饱和食盐水制乙炔 |
下列有关实验装置的说法中正确的是 ( )。
| A.用图1装置制取干燥纯净的NH3 |
| B.用图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.用图3装置可以完成“喷泉”实验 |
| D.用图4装置测量Cu与稀硝酸反应产生气体的体积 |







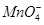 +8H+=5Fe3++Mn2++4H2O),步骤为:
+8H+=5Fe3++Mn2++4H2O),步骤为:
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
