题目内容
NH4HCO3是一种离子化合物,下列关于该物质的叙述错误的是
| A.所含四种元素的原子半径由小到大的顺序为:H<O<N<C |
| B.同周期的三种元素的得电子能力由大到小的顺序为: O>N>C |
| C.除去NaCl固体中混有少量的NH4HCO3固体可以采用加热的方法 |
D.其与足量氢氧化钠溶液共热的离子方程式为:NH4++OHˉ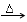 NH3↑+H2O NH3↑+H2O |
D
试题分析:A.H是第一周期的元素,原子核外有一个电子层,C、N、O都是第二周期的元素,原子核外有两个电子层。对于电子层数不同的元素来说,原子的电子层数越多原子半径越大;对于电子层数相同的元素来说,元素的原子序数越大,原子半径就越小。所以这四种元素的原子半径由小到大的顺序是H<O<N<C。正确。B.同周期的三种元素从左到右,元素的非金属性逐渐增强,元素的原子得到电子的能力逐渐增强。故得电子能力由大到小的顺序为: O>N>C 。正确。C.加热时NH4HCO3发生分解反应:NH4HCO3
 NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ
NH3↑+H2O+CO2↑。不会有残留的固体杂质。因此可以采用加热的方法除去NaCl固体中混有少量的NH4HCO3杂质。正确。D.NaOH与NH4HCO3电离产生的阴离子、阳离子均发生反应。故其与足量氢氧化钠溶液共热的离子方程式为:HCO3-+NH4++2OHˉ NH3↑+H2O + CO32-.错误。4HCO3的化学性质的知识。
NH3↑+H2O + CO32-.错误。4HCO3的化学性质的知识。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
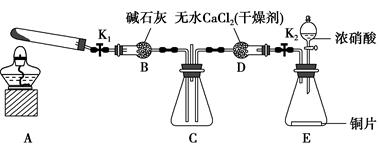
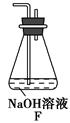
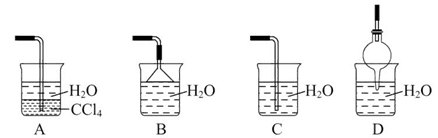
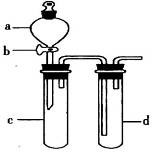
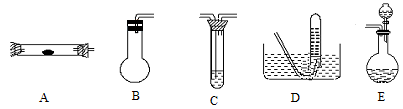
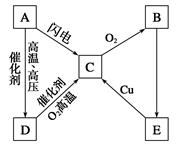
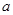 方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。
方案制N2时,需要的氨气用生石灰和浓氨水作原料制取,则宜采用上述仪器中的____________(填A、B、C……下同)作NH3的发生器,要制取并收集N2,还须选用到的仪器是___________。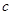 方案制取N2,则氮气中一定混有何种杂质气体 ______________________
方案制取N2,则氮气中一定混有何种杂质气体 ______________________ 方案结合使用越来越受到人们的关注,这种方法与
方案结合使用越来越受到人们的关注,这种方法与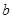 方案相比,其优越性在于____________。
方案相比,其优越性在于____________。