题目内容
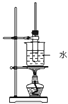
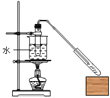
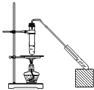
【题目】已知二氧化硫能够与一些卤素单质发生反应生成强酸。某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2) 中的SO2的含量。
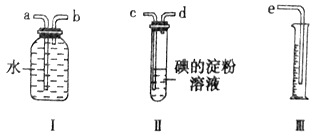
(1)若原料气以左向右流向时,上述装置组装连接的顺序是:原料气→____________(填a、b、c、d、e)。
(2)写出装置Ⅱ中发生反应的离子方程式_____________________ ;当装置Ⅱ中出现___________________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05mol/L、体积为20mL,收集到的N2与O2的体积为297.6 mL(己折算为标准状况下的体积),SO2的体积分数为______________。
【答案】 c→d→b→a→e SO2+I2+2H2O=4H++SO42-+2I- 蓝色褪去 7%
【解析】(1)原料气通过碘的淀粉溶液,碘能氧化H2SO3,生成H2SO4,吸收二氧化硫气体,通过装置Ⅰ、Ⅲ排水量气测定氧气和氮气的体积,因此连接装置接口顺序为:c→d→b→a→e;(2)装置Ⅱ是吸收二氧化硫气体,碘的淀粉溶液是蓝色,反应的离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-,当蓝色褪去,说明碘单质全部反应,应停止通气,否则二氧化硫吸收不完全,造成误差;(3)反应方程式SO2+I2+2H2O=4H++SO42-+2I-,由条件知n(SO2)=n(I2)=0.05 mol/L×0.02 L=0.001 mol,即22.4 mL,所以工业原料气总体积为297.6 mL+22.4 mL=320 mL,因此SO2的体积分数=22.4mL/320mL×100%=7%。

 名校课堂系列答案
名校课堂系列答案【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量 浓度(mol·L-1) | NaOH物质的量 浓度(mol·L-1) | 混合溶 液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请根据要求回答:
(1)②组情况表明,c________ (选填“大于”、“小于”或“等于”)0.2。混合液中离子浓度c(A-)与c(Na+)的大小关系是______________________________________。
(2)从③组实验结果分析,说明HA的电离程度________(选填“大于”、“小于”或“等于”)NaA的水解程度,该混合溶液中离子浓度由大到小的顺序是_____________________________。
(3)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。写出该混合溶液中下列算式的结果(不能作近似计算)。c(Na+)-c(A-)=________mol·L-1; c(OH-)-c(HA)=________mol·L-1。