题目内容
【题目】下列实验操作能达到实验目的的是( )
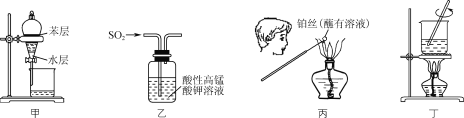
A.用装置甲从碘水中萃取碘B.用装置乙验证SO2的漂白性
C.用装置丙检验溶液中是否有K+D.用装置丁将FeCl3溶液蒸干制备FeCl3
【答案】A
【解析】
A. 苯与水不互溶,与碘不反应,且I2在苯中的溶解度远大于在水中的溶解度,因此可用苯作萃取剂,萃取碘水中的I2,可以达到实验目的,A项正确;
B. SO2与酸性的高锰酸钾之间因发生氧化还原反应而使高锰酸钾溶液褪色,因此不能证明SO2具有漂白性,不能达到实验目的,B项错误;
C. 用焰色反应检验K+时,观察火焰的颜色时要透过蓝色的钴玻璃,不能达到实验目的,C项错误;
D. 将FeCl3溶液蒸干的过程中,Fe3+水解生成Fe(OH)3,加热后生成Fe2O3,因此将FeCl3溶液蒸干不能制备纯净的FeCl3,不能达到实验目的,D项错误;
答案选A。
原物质 | 蒸干灼烧后固体物质 |
Ca(HCO3)2 | CaCO3或CaO |
NaHCO3 | Na2CO3 |
KMnO4 | K2MnO4和MnO2 |
NH4Cl | 分解为NH3和HCl无固体物质存在 |

【题目】部分中学化学常见元素原子的结构、性质及用途如表所示:
元素 | 结构、性质及用途 |
A | A是一种常见的金属元素,它的一种氧化物是具有磁性的黑色晶体 |
B | B元素的一种核素可用于考古时测定一些文物的年代 |
C | C 原子最外层电子总数是次外层电子总数的3倍 |
D | D 原子的2p能级处于半充满状态 |
E | E的单质为灰黑色具有金属光泽的固体,是太阳能电池板的常用材料 |
(1)A元素基态原子的电子排布式为_______。
(2)B、C、D元素的第一电离能由大到小的顺序为______(填元素符号)。
(3)简单气态氢化物的热稳定性:C ____E(填“>”或“<”)。
(4)根据VSEPR模型预测D的氢化物的立体构型为______,中心原子D的杂化轨道类型为____;BD-中σ键与π键的数目之比为_________。
(5)足量D的氢化物水溶液与CuSO4溶液反应生成深蓝色的配离子,该配离子用结构示意图表示为___。