题目内容
【题目】氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛。
(1)在2%的氢氧化钠溶液中通入氟气,发生反应:2F2+2NaOH═2NaF+H2O+OF2。该反应氧化剂与还原剂的物质的量之比为____,OF2的电子式为___。
(2)SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键,已知1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ,试写出固态S单质和氟气反应生成SF6气体的热化学方程式______。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)![]() C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)
C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)![]() C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
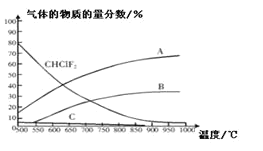
① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________(填标号)。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.v正(C2F4)=2V逆(HCl) D.c(C2F4)与c(HCl)比值保持不变
② 图中曲线A表示的物质是:______(填化学式)。
③反应2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是______。
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=______。(用含a和b的代数式表示)
【答案】2:1 ![]() S(s) + 3F2(g) = SF6(g) ΔH = -1220kJ/mol 2.5×1024 BD HCl > C2F4的产率高,副产物C3F6的含量几乎为0
S(s) + 3F2(g) = SF6(g) ΔH = -1220kJ/mol 2.5×1024 BD HCl > C2F4的产率高,副产物C3F6的含量几乎为0 ![]()
【解析】
⑴2F2+2NaOH═2NaF+H2O+OF2,该反应中F的化合价从0价变为-1价,O元素的化合价从-2价变为+2价,氧化剂为F2,还原剂为NaOH,氧化剂与还原剂的物质的量之比为2:1,二氟化氧分子中F原子最外层达到8电子稳定结构,其正确的电子式为![]() 。
。
⑵反应热ΔH=反应物总键能![]() 生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol。
生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol。
⑶Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,该反应的平衡常数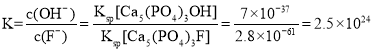 。
。
⑷①A选项,制备四氟化烯反应前后都为气体,在恒容的条件下,混合气体密度始终保持改变,故A错误;B选项,制备四氟化烯的反应,反应前后物质的量在变化,混合气体的平均相对分子质量![]() ,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确。
,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确。
②根据两个方程式得出可知氯化氢的物质的量一直在增加,且增加量最大,因此A为氯化氢。
③根据图示可知,随着温度的升高CHClF2物质的量在减少,所以正反应为吸热反应,即2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H > 0。
C2F4(g)+2HCl(g)的△H > 0。
④通过图示可知,在900C以上,副产物C3F6的含量几乎为0,工业上常在900C以上通过裂解CHClF2来制取C2F4,其原因是C2F4的产率高,副产物C3F6的含量几乎为0。
⑸盐酸和NaF之间反应生成氯化钠和HF,溶液显示中性,所以NaF会剩余,则生成的
c(HF) = 0.5bmol/L,溶液呈中性,溶液显中性,故c(H+)= c(OH-)=1×10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(F-) + c(Cl-)=c(Na+) =0.5amol/L,所以c(F-) = (0.5a
-0.5b) mol/L,HF的电离常数![]() 。
。
⑴2F2+2NaOH═2NaF+H2O+OF2,该反应中F的化合价从0价变为-1价,O元素的化合价从-2价变为+2价,氧化剂为F2,还原剂为NaOH,氧化剂与还原剂的物质的量之比为2:1,二氟化氧分子中F原子最外层达到8电子稳定结构,其正确的电子式为![]() ,故答案为:2:1;
,故答案为:2:1;![]() 。
。
⑵反应热ΔH=反应物总键能![]() 生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol,故答案为:S(s) + 3F2(g) = SF/span>6(g) ΔH = -1220kJ/mol。
生成物总键能,所以对于S(s) + 3F2(g) = SF6(g),其反应热ΔH = 280kJ/mol+3×160kJ/mol - 6×330kJ/mol = -1220kJ/mol,故答案为:S(s) + 3F2(g) = SF/span>6(g) ΔH = -1220kJ/mol。
⑶Ca5(PO4)3F溶度积比Ca5(PO4)3OH小,该反应的平衡常数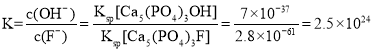 ;故答案为:2.5×1024。
;故答案为:2.5×1024。
⑷①A选项,制备四氟化烯反应前后都为气体,在恒容的条件下,混合气体密度始终保持改变,故A错误;B选项,制备四氟化烯的反应,反应前后物质的量在变化,混合气体的平均相对分子质量![]() ,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确;综上所述,答案为:BD。
,气体的质量在反应前后是守恒的,是一个反应前后物质的量会变化的反应,所以当M不变时,达到了平衡,故B正确;C选项,v正(C2F4)=2V逆(HCl),一正一逆满足,但不满足登记计量系数之比,故C错误;D选项,c(C2F4)与c(HCl)比值保持不变,说明各物质的量不变,达到了平衡,故D正确;综上所述,答案为:BD。
②根据两个方程式得出可知氯化氢的物质的量一直在增加,且增加量最大,因此A为氯化氢,故答案为:HCl。
③根据图示可知,随着温度的升高CHClF2物质的量在减少,所以正反应为吸热反应,即2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H > 0,故答案为:> 。
C2F4(g)+2HCl(g)的△H > 0,故答案为:> 。
④通过图示可知,在900C以上,副产物C3F6的含量几乎为0,工业上常在900C以上通过裂解CHClF2来制取C2F4,其原因是C2F4的产率高,副产物C3F6的含量几乎为0,故答案为:C2F4的产率高,副产物C3F6的含量几乎为0。
⑸盐酸和NaF之间反应生成氯化钠和HF,溶液显示中性,所以NaF会剩余,则生成的
c(HF) = 0.5bmol/L,溶液呈中性,溶液显中性,故c(H+)= c(OH-)=1×10-7mol/L,根据电荷守恒,c(Cl-)=0.5bmol/L,c(F-) + c(Cl-)=c(Na+) =0.5amol/L,所以c(F-) = (0.5a
-0.5b) mol/L,HF的电离常数![]() ,故答案为:
,故答案为:![]() 。
。

【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/g | 0.255 | 0.385 | 0.459 |
生成气体/ml | 280 | 336 | 336 |
(1)该盐酸的物质的量浓度____________;
(2)合金中Mg、Al的物质的量之比为___________;
(3)在丙组实验后,向容器中加入1mol/L的NaOH溶液,恰好使合金中的铝元素全部转化为AlO2-,并使Mg2+刚好沉淀完全,则溶液中AlO2-的物质的量为__________mol;溶液中Na+的物质的量为_________mol;所加NaOH溶液的体积为_________mL。