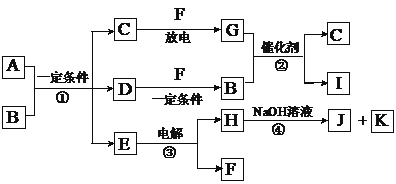
题目内容
【题目】室温下,用0.1 mol·Lˉ1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
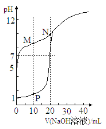
A.HX为弱酸
B.M点c(HX)-c(X-)﹥c(OH-)-c(H+)
C.将P点和N点的溶液混合,呈酸性
D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
【答案】C
【解析】
试题分析:A.未滴定时,0.1molL-1HCl溶液pH为1,由图可知0.1mol/L HX溶液的pH>5,则HX弱酸,故A正确;B.M点为等浓度NaX、HX混合溶液,且溶液呈碱性,说明X-的水解程度大于HX的电离程度,由物料守恒可知:2c(Na+)=c(X-)+c(HX),结合电荷守恒c(Na+)+c(H+)=c(X-)+c(OH-),联立可得:c(X-)+c(HX)+2c(H+)=2c(X-)+2c(OH-),整理得:c(HX)-c(X-)=2c(OH-)-2c(H+)>c(OH-)-c(H+),故B正确;C.P点溶液中NaCl、HCl物质的量相等,N点为NaX溶液,NaX物质的量为HCl的2倍,混合后为NaCl、NaX、HX混合溶液,且溶液中NaX与HX的浓度相等,由于X-的水解程度大于HX的电离程度,呈碱性,故C错误;D.根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(X-)+c(OH-),溶液pH=7,则c(Na+)=c(Cl-)+c(X-),由物料守恒可知c(Na+)=c(X-)+c(HX),联立可得c(HX)=c(Cl-),而溶液为NaCl、NaX、HX的混合溶液,相同浓度下X-的水解程度大于HX的电离程度,由于溶液为中性,则溶液中c(NaX)<c(HX),故溶液中c(Na+)>c(HX)=c(Cl-)>c(X-),故D正确;故选C。

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案