题目内容
【题目】某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数。
甲方案:
实验步骤为:①称量空坩埚的质量为A g
②称量装有试样的坩埚质量为B g ③加热
④冷却⑤称量坩埚和残余物的质量为C g
⑥重复③至⑤操作,直至恒重,质量为D g
(1)坩埚中发生反应的化学方程式为__________________。
(2)计算Na2CO3质量分数必须用到的测定数据为___________(填“A”、“B”、“C”或“D”)。
乙方案:
在天平上准确称取0.3000 g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.1000 mo1·L-1,的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3。重复上述操作两次,消耗盐酸的体积为20.00 mL。
(3)配制上述盐酸标准溶液100 mL,若用2.0 mol·L-1HCl进行配制,需用滴定管量取该HCl溶液________mL;定容时俯视刻度线,将导致配制的溶液浓度___________(填“偏高”、“偏低”或“没有影响”)。
(4)样品中Na2CO3的质量分数为___________(用百分数表示,精确到0.1%)。
丙方案:
称取m g样品,选用下图部分装置测定样品与硫酸反应生成的气体体积。
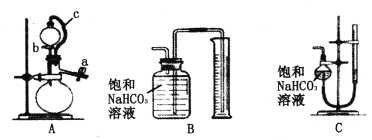
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,如图连接好装置,关闭止水夹a,用止水夹夹住橡皮管c,打开活塞b。若装置不漏气,则观察到的现象为__________________。实验时,装置A中c的作用_____________、_____________。
(6)为了提高测定的准确性,应选用装置A和__________(填写字母标号)进行实验。
【答案】(1)2NaHCO3![]() Na2CO3+CO2↑ +H2O ↑
Na2CO3+CO2↑ +H2O ↑
(2)A、B和D (3)5.0 偏高(4)70.7%
(5)无法确定(2分) 平衡气压,有利于液体流出(1分) 减小由于液体流下引起的体积误差 (1分)(6)C (1分)
【解析】
试题分析:(1)碳酸氢钠不稳定受热易分解,坩埚内发生反应是:2NaHCO3![]() Na2CO3+CO2↑ +H2O ↑;(2)此方案是先测量碳酸氢钠的质量,然后用总质量减去碳酸氢钠的质量,得到碳酸钠的质量,从而求出碳酸钠的质量分数,因此需要A和B,求碳酸氢钠的质量采用差量法求解,因此需要D的质量,C只是说明碳酸氢钠是否完全分解,不需要;(3)量筒的精确度是0.1ml,稀释前后溶质物质的量不变,即100*10-3*0.1=V(HCl)*10-3*2,解得V(HCl)=5.0ml,定容时,俯视度数,所配溶液的体积减少,浓度偏高;(4)三次消耗盐酸的体积分别是20.01、19.99、20.00,平均消耗盐酸体积为20.00ml,根据反应方程式:n(Na
Na2CO3+CO2↑ +H2O ↑;(2)此方案是先测量碳酸氢钠的质量,然后用总质量减去碳酸氢钠的质量,得到碳酸钠的质量,从而求出碳酸钠的质量分数,因此需要A和B,求碳酸氢钠的质量采用差量法求解,因此需要D的质量,C只是说明碳酸氢钠是否完全分解,不需要;(3)量筒的精确度是0.1ml,稀释前后溶质物质的量不变,即100*10-3*0.1=V(HCl)*10-3*2,解得V(HCl)=5.0ml,定容时,俯视度数,所配溶液的体积减少,浓度偏高;(4)三次消耗盐酸的体积分别是20.01、19.99、20.00,平均消耗盐酸体积为20.00ml,根据反应方程式:n(Na
2CO3)=0。212g,碳酸钠的质量分数为0.212/0.3000 *100%=70。7%;(5)c的作用是使分液漏斗中的压强和烧瓶中的压强相等,能够使液体顺利滴下,因此无法确定是否漏气;平衡分压,有利于液体流出;减小由于液体流下引起的体积误差;(6)通过排水法测量气体体积,B装置中导管含有水,这部分水是气体排出,无法读取体积,因此C装置可以减少误差。

 阅读快车系列答案
阅读快车系列答案