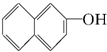
题目内容
14.一定量的氢气在氯气中燃烧,所得混合物用200mL 3.00mol•L-1的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.100mol.(1)原NaOH溶液的质量分数为10.7%.
(2)所得溶液中Cl-的物质的量为0.500mol.
(3)参加反应的氢气在标况下的体积为4.48L.
分析 (1)溶液质量分数与物质的量浓度的换算公式为c=$\frac{1000ρω}{M}$,代入数据计算原NaOH溶液的质量分数;
(2)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-);
(3)由题意可知氯气过量,反应后所得混合气体为HCl和Cl2,涉及反应有:HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO),与H2反应的Cl2为n(Cl2)=$\frac{1}{2}$×[n(Cl-)-n(NaClO)],据此计算解答.
解答 解:(1)溶液质量分数与物质的量浓度的换算公式为:c=$\frac{1000ρω}{M}$,代入数据得原NaOH溶液的质量分数w(NaOH)=$\frac{cM}{1000ρ}$=$\frac{3×40}{1000×1.12}$=10.7%,
故答案为:10.7%;
(2)由于最终溶液中的溶质只有NaCl、NaClO,则n(Na+)=n(Cl-)+n(ClO-),所以,n(Cl-)=0.2L×3.00 mol•L-1-0.100 mol=0.500 mol,
故答案为:0.500;
(3)由题意可知氯气过量,反应后所得混合物气体为HCl和Cl2,
涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,
据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,
与H2反应的Cl2为n(Cl2)=$\frac{1}{2}$×[n(Cl-)-n(NaClO)]=$\frac{1}{2}$×(0.5mol-0.1mol)=0.2mol,则n(H2)=0.2mol,故V(H2)=0.2mol×22.4L/mol=4.48L,
故答案为:4.48.
点评 本题考查化学方程式计算、混合物计算,侧重于学生计算能力和分析能力的考查,注意判断反应的程度以及相关方程式的书写,注意利用守恒思想解答.

 名校课堂系列答案
名校课堂系列答案| A. | 16种 | B. | 11种 | C. | 8种 | D. | 6种 |
| A. | 水很稳定(1000℃以上才会部分分解)是因为水中含有大量的氢键所致 | |
| B. | 乳酸(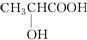 )有一对手性异构体,因为其分子中含有一个手性碳原子 )有一对手性异构体,因为其分子中含有一个手性碳原子 | |
| C. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| D. | 由图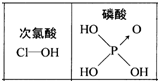 知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数 |
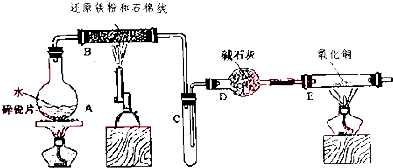
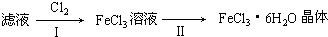
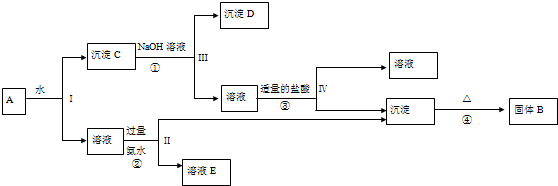
 与
与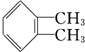
 与
与
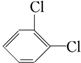 与
与
 与
与