��Ŀ����
����Ŀ����14�֣���ҵ�Ͽ��Բ����Ȼ�ԭ���Ʊ�����þ��þ�е�Ϊ1107�����۵���648.8������
��1������ʽ̼��þ[4MgCO3��Mg(OH)2��5H2O]�ͽ�̿��һ��������ϣ�������չ�ʽ¯����������500������һ��ʱ�䣬Ȼ��������1450����Ӧ�Ƶ�þ��
����̼��ԭ���Ʊ�����þ��Ҫ������ж����ڿ����н��У���ԭ���� ��
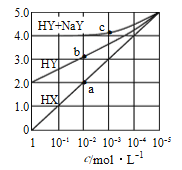
����̿���ʽ̼��þ�����ʵ����ı�ֵ��ͬ��þ�Ļ�ԭ���нϴ�Ӱ�죬�����ͼ������ֵ����15��1ʱ����ԭ���½���ԭ������� ��
����ʽ̼��þ�ֽ���ͼ��ʾ��д����1450����Ӧ�Ƶ�þ�Ļ�ѧ��Ӧ����ʽ ��


��2����ҵ�Ͽ��Բ���MgCl2��Һ��Na2CO3��Һ����Ʊ���ʽ̼��þ��д����Ӧ���ӷ���ʽ ��
��Ӧ����68�����¶Ȳ��˸���68����ԭ���� ��
��3����ҵ���õ��MgCl2��Һ����Mg(OH)2����ͼ��Ȼ����Mg(OH)2����Һ���������еĶ�����̼�����ٶ�����̼���ŷ�ͬʱ������ʽ̼��þ���õ�ص������缫��ӦʽΪ �����ʱ���õ�������Ϊ ��

���𰸡�ÿ��2��
��1�����ڿ�����þ����������
�������Ľ�̿������þ�������ռ�����þ������
��MgO+C = Mg+CO
��2��5Mg2++5CO32-+ H2O = 4MgCO3��Mg(OH)2 ��+ CO2�� ��ʽ̼��þ���ȷֽ��ˮ��Ϊ������þ
��3��Mg2+ + 2H2O +2e- = Mg(OH)2��+H2�� HCl
��������
���������
��1��������þ���ʻ��ã��ڿ��������������͵����ȷ�Ӧ������Ҫ�ų�������Ӧ��������ֵ����15��1ʱ���ǽ�̿��������̿���нϴ�ı���������������ã�������þ��������þ�IJ��ʽ��ͣ�������ͼ������ȷ���ֽ�����ղ���Ϊ����þ��5��40/484=0.41������Ϊ��̿���������Բ���Ϊþ��CO��
��2���÷�ӦΪþ���Ӳ���ˮ��õ��IJ��5Mg2++5CO32-+ H2O = 4MgCO3��Mg(OH)2 ��+ CO2������ʽ̼��þ���ȷֽ�Ϊ����þ��ˮ��Ϊ������þ��һ���ֽ�Ϊ����þ����3�����ʱ���������ӷŵ磬ӦΪ�����ӷŵ������������Һ�����ɵ�������������þ���ӷ�Ӧ����������þ�����������������ŵ���������ӣ�������ͨ�������ӽ���Ĥ�������������õ����ḱ��Ʒ��

����Ŀ��һ�������£���2 L�ܱ������ڣ���Ӧ2NO2(g)![]() N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
��1����NO2��ʾ0��2 s�ڸ÷�Ӧ��ƽ���ٶ�___________���ڵ�5 sʱ��NO2��ת����Ϊ_____�������ϱ����Կ��������ŷ�Ӧ���У���Ӧ������С����ԭ����_____________________��
��2��������Ӧ�ڵ�3 s��ﵽƽ�⣬��˵���÷�Ӧ�Ѵﵽƽ��״̬����______��
a����λʱ���ڣ�����2 mol NO2��ͬʱ����1 mol��N2O4
b��������ѹǿ���ֲ���
c��v��(NO2)��2v��(N2O4)
d���������ܶȱ��ֲ���
��3����2 s�ڣ��÷�Ӧ_______�������ա��ų����� _______������