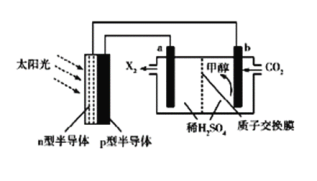
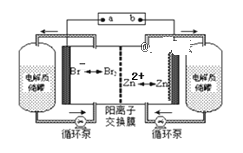
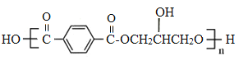��Ŀ����
����Ŀ�������£���0.1000mol/L NaOH��Һ�ζ�20.00mL 0.1000mol/L HCl��Һ���ζ�������ͼ��ʾ������˵������ȷ����
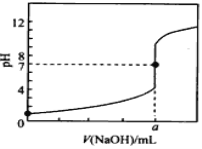
A. a=20.00
B. �ζ������У����ܴ��ڣ�c��Cl������c��H+����c��Na+����c��OH����
C. �������ỻ����ͬŨ�ȵĴ��ᣬ��ζ���pH=7ʱ��a��20.00
D. ���÷�̪��ָʾ�������ζ�����Һ��������ɫ��Ϊdz��ɫʱ����ֹͣ�ζ�
���𰸡�D
��������
A��NaOH��Һ��HCl��Һǡ�÷�Ӧʱ������20.00mLNaOH��Һ������ǿ��ǿ����,��Һ����������A��ȷ��
B���ζ����������ʱ, c��Cl������c��H+����c��Na+����c��OH����,��B��ȷ;
C��NaOH�ʹ���ǡ�÷�Ӧʱ����ǿ��������,��Һ�ʼ���,���Եζ���pH=7ʱ, a��20.00,��C��ȷ;
D���÷�̪��ָʾ�������к͵ζ�ʱ,����Һ����ɫ��Ϊ��ɫʱ,��30���ڲ���ɫ,ֹͣ�ζ�,��D����;
����������������ȷ��ΪD��

��ϰ��ϵ�д�
 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
�����Ŀ