题目内容
【题目】某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。

图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。
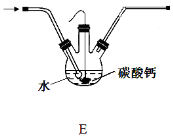
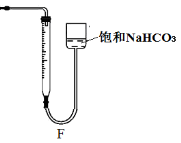
图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。
【答案】(1)MnO2+4HCl(浓) ![]() MnCl2+ Cl2↑+2H2O ;(2)除去氯气中的氯化氢杂质;(3)装有KI淀粉溶液的棉球变蓝,装有FeCl2溶液的棉球变黄色;(4)①CaCO3消耗了氯水中的HCl,使Cl2+H2O
MnCl2+ Cl2↑+2H2O ;(2)除去氯气中的氯化氢杂质;(3)装有KI淀粉溶液的棉球变蓝,装有FeCl2溶液的棉球变黄色;(4)①CaCO3消耗了氯水中的HCl,使Cl2+H2O![]() HCl+HClO平衡向右移动,HClO浓度增大;②Ca(HCO3)2;③
HCl+HClO平衡向右移动,HClO浓度增大;②Ca(HCO3)2;③![]()
【解析】
试题分析:(1)利用MnO2的氧化性强于Cl2,反应方程式为:MnO2+4HCl(浓) ![]() MnCl2+ Cl2↑+2H2O ;(2)氯气中混有HCl(g),饱和食盐水的作用除去HCl气体;(3)氯气的氧化性强于I2,发生的反应是Cl2+2I-=I2+2Cl-,淀粉遇碘单质变蓝,2Fe2++Cl2=2Fe3++2Cl-,棉球有浅绿色变为黄色;(4)①Cl2+H2O
MnCl2+ Cl2↑+2H2O ;(2)氯气中混有HCl(g),饱和食盐水的作用除去HCl气体;(3)氯气的氧化性强于I2,发生的反应是Cl2+2I-=I2+2Cl-,淀粉遇碘单质变蓝,2Fe2++Cl2=2Fe3++2Cl-,棉球有浅绿色变为黄色;(4)①Cl2+H2O![]() HCl+HclO,盐酸的酸性强于碳酸,CaCO3+2HCl=CaCl2+CO2↑+H2O,促使平衡向正反应方向移动,c(HClO)增大;②碳酸钙和酸反应的实质为2CaCO3+2HCl=Ca(HCO3)2+CaCl2,Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑把所得溶液加入盐酸,有大量的CO2产生,说明溶液中有Ca(HCO3)2;③减少CaCO3的质量为ag,说明反应碳酸钙的质量为ag,连接F装置收集到气体为bL,Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,求出n(Ca(HCO3)2)=b/44.8mol,根据钙元素守恒,则n(CaCl2)=(a/100-b/44.8)mol,则c(CaCl2)=(a/100-b/44.8)/100×10-3mol·L-1。
HCl+HclO,盐酸的酸性强于碳酸,CaCO3+2HCl=CaCl2+CO2↑+H2O,促使平衡向正反应方向移动,c(HClO)增大;②碳酸钙和酸反应的实质为2CaCO3+2HCl=Ca(HCO3)2+CaCl2,Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑把所得溶液加入盐酸,有大量的CO2产生,说明溶液中有Ca(HCO3)2;③减少CaCO3的质量为ag,说明反应碳酸钙的质量为ag,连接F装置收集到气体为bL,Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑,求出n(Ca(HCO3)2)=b/44.8mol,根据钙元素守恒,则n(CaCl2)=(a/100-b/44.8)mol,则c(CaCl2)=(a/100-b/44.8)/100×10-3mol·L-1。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】二氧化硫是一种重要的化工原料,主要用于生产硫酸、亚硫酸盐等。请回答:
(1)已知2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。
2SO3(g)是工业制硫酸的关键反应。下图为不同温度(T1、T2)下SO2的转化率随时间的变化曲线。

①T1__________(填“>”“<”或“=”)T2,判断的依据是_____________________;该反应为____________(填“放”或“吸”)热反应,判断的依据是___________________。
②下表为一定温度和压强下,4种投料比[n(SO2):n(O2)]分别为2:18、4:15、7:11和8:10时SO2的平衡转化率。
投料比 | a | b | c | d |
SO2平衡转化率/% | 97.1 | 96.8 | 95.8 | 90.0 |
i.b对应的投料比为_____________。
ii.投料比为8:10时,平衡混合气体中SO3体积分数为_________________。
(2)钠碱循环法吸收硫酸厂尾气中的SO2并将其转化为硫酸的工艺如下:

①吸收池中发生反应的离子方程式是_____________________。
②电解池的构造示意图如下:
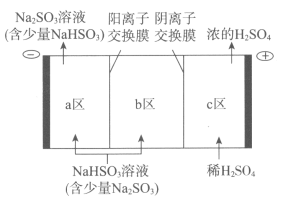
i.在图中标示出b区的Na+和HSO3-的移动方向。
ii.请结合生成H2SO4的电极反应式说明c区除得到浓的硫酸外,还会得到什么物质:__________________。
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH,前者的PH比后者的大 | 元素非金属性:S>C |
B | 向盛有Fe(NO3)2溶液的试管中加入0.lmol.L-1H2SO4溶液,试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
D | 向溶液中滴加盐酸酸化的BaC12溶液,产生白色沉淀 | 溶液中一定含有SO42- |
A. A B. B C. C D. D
