题目内容
【题目】碳和氮的化合物在生产生活中广泛存在。回答下列问题:
(1)三氯化氮(NCl3)是一种黄色、油状、具有刺激性气味的挥发性有毒液体,其原子均满足8e—结构。写出其电子式_____________________。氯碱工业生产时,由于食盐水中通常含有少量NH4Cl,而在阴极区与生成的氯气反应产生少量三氯化氮,该反应的化学方程式为______________。
(2)已知:2CO2(g) + 3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l) △H=-4a kJ/mol
CO2(g) +2NaOH(aq)=Na2CO3(aq)+H2O(l) △H=-b kJ/mol
该条件下CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式为:____________。
(3)利用CO可以将NO转化为无害的N2,其反应为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
N2(g)+2CO2(g),向容积均为IL的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入相同量NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(CO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(CO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(CO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
②该反应的△H______0(填“>”或“<”)。
③甲、丙容器达到平衡时,CO的转化率为α(甲)________α(乙)(填“>”,“< ”,“=”)
(4)常温下,在(NH4)2C2O4溶液中,反应NH4++C2O42—+H2O![]() NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
NH3·H2O+HC2O4—的平衡常数K=___。(已知常温下,H2C2O4的电离平衡常数Ka1≈5×10-2,Ka2≈5×10-5 H2O的电离平衡常数Kw=1×10-14 NH3·H2O的电离平衡常数Kb≈2×10-5)
【答案】![]() NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol 0.0125mol/(L·min) < > 1×10-5
NH4Cl+3Cl2=NCl3+4HCl NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol 0.0125mol/(L·min) < > 1×10-5
【解析】
(1)三氯化氮原子均满足8e-结构,故电子式为 ;氯化铵与氯气生成三氯化氮和氯化氢;
;氯化铵与氯气生成三氯化氮和氯化氢;
(2)根据盖斯定律得出CO2与NaOH溶液反应生成NaHCO3的热化学反应方程式;
(3)①根据v(CO)=△c/△t计算CO的平均反应速率;
②根据甲乙容器可知,乙容器80min达到平衡,甲容器在120min达到平衡,故乙容器的温度高于甲容器,温度高CO的平衡浓度大,平衡逆向移动,所以该反应属于放热反应;
③分别求出甲、乙两容器中CO的转化率,比较其大小;
(4)根据平衡常数的公式进行计算。
(1)三氯化氮原子均满足8e-结构,故电子式为 ;氯化铵与氯气生成三氯化氮和氯化氢,其方程式为:NH4Cl+3Cl2=NCl3+4HCl,
;氯化铵与氯气生成三氯化氮和氯化氢,其方程式为:NH4Cl+3Cl2=NCl3+4HCl,
故答案为: ;NH4Cl+3Cl2=NCl3+4HCl。
;NH4Cl+3Cl2=NCl3+4HCl。
(2)根据序号1的热化学方程式为2CO2(g)+3NaOH(aq)=NaHCO3(aq)+Na2CO3(aq)+H2O(l)
△H=-4akJ/mol,序号2的热化学方程式为CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) H=bkJ/mol,根据盖斯定律可得:NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol;
故答案为:NaOH(aq)+CO2(g)=NaHCO3(aq) △H=-(4a-b)kJ/mol。
(3)①甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=v(CO)=△c/△t=(2.00mol-1.5mol)÷1L÷40min=0.0125mol/(Lmin);
故答案为:0.0125mol/(Lmin)。
②根据甲乙容器可知,乙容器在80min达到平衡,甲容器在120min达到平衡,故乙容器的温度高于甲容器,温度高CO的平衡浓度大,平衡逆向移动,所以该反应属于放热反应,△H<0;
故答案为:<。
③甲容器达到平衡时,CO的转化率为(2.00-0.80)/2.00×100%=60%;乙容器达到平衡时CO的转化率为(2.00-1.00)/2.00×100%=50%;所以CO的转化率为α(甲)>α(乙),
故答案为:>。
(4)NH4++C2O42-+H2O![]() NH3H2O+HC2O4-的平衡常数K=c(HC2O4-)c(NH3H2O)/(NH4+)c(C2O42-)=c(HC2O4-)c(NH3H2O)c(H+)c(OH-)/c(NH4+)c(C2O42-)c(H+)c(OH-)=Kw/KbKa2=1×10-14/2×10-55×10-5=1×10-5;
NH3H2O+HC2O4-的平衡常数K=c(HC2O4-)c(NH3H2O)/(NH4+)c(C2O42-)=c(HC2O4-)c(NH3H2O)c(H+)c(OH-)/c(NH4+)c(C2O42-)c(H+)c(OH-)=Kw/KbKa2=1×10-14/2×10-55×10-5=1×10-5;
故答案为:1×10-5。

 快乐5加2金卷系列答案
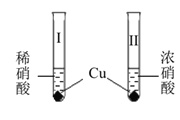
快乐5加2金卷系列答案【题目】室温下,某兴趣小组用下图装置在通风橱中进行如下实验:
实验 | 现象 |
| 试管中开始无现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色. |
试管中剧烈反应,迅速生成大量红棕色气体, 溶液呈绿色;之后向绿色溶液中持续通入N2, 溶液变为蓝色. |
下列说法正确的是
A. 试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B. 等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更多
C. 换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D. 试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2
【题目】某化学兴趣小组利用下图装置探究验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物并测定CuFeS2的纯度(杂质为SiO2)。
实验步骤:①组装好仪器,检查装置的气密性良好。②加入药品,打开弹簧夹,从左口不断鼓入空气。③点燃B处的酒精喷灯,高温灼烧石英管中黄铜矿的样品。

请回答下列问题。
(1)仪器A中的试剂是________,其作用为________。
(2)为检验灼烧氧化黄铜矿产生的气体,则C、D中的试剂可选择________(多选)。
a.Na2S溶液、NaOH溶液
b.BaCl2溶液、NaOH溶液
c.品红溶液、NaOH溶液
d.KMnO4溶液、NaOH溶液
(3)查阅资料:
①样品经煅烧后得到的固体可能为泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO)。
②Cu2O与稀H2SO4的反应为:Cu2O+H2SO4=Cu+CuSO4+H2O
探究Ⅰ:为验证熔渣的成分,取分离出的熔渣少许于试管中,加入适量的稀硫酸溶解,取两份所得液。完成下表中横线上的内容。
试样 | 加入试剂及操作 | 实验现象 | 得出结论 |
第一份 | 滴入几滴K3Fe(CN)6]溶液 | ________ | 含FeO |
第二份 | 滴入几滴________溶液 | 溶液变为血红色 | 含Fe2O3 |
探究Ⅱ:设计实验方案验证泡铜中是否含有Cu2O?________。
(4)为测定CuFeS2的纯度,称取a g的黄铜矿样品充分燃烧后,甲、乙两组同学设计如下两个不同的实验方案(以下纯度结果均用含相应字母的代数式表示)。
甲方案:若C试管中为足量的H2O2和NaOH的混合溶液,吸收完气体后向C中加入过量的BaCl2溶液振荡且静置,经过滤后处理得到固体为w g,则CuFeS2的纯度为________。写出C试管中吸收气体时的总反应的离子方程式________。
乙方案:从上述煅烧产物中分离出泡铜,使其完全溶于稀硝酸并配成250mL的溶液,取出25.00mL该溶液用c mol·L-1的标准液EDTA(用H2Y2-表示)滴定至终点(滴定荆不与杂质反应),消耗EDTA标准液V mL,则CuFeS2的纯度为________。(滴定时的反应为:Cu2++H2Y2-=CuY2-+2H+)