题目内容
【题目】Ⅰ、制取氨气并完成喷泉实验(图中夹持装置均已略去)。

(1)写出实验室制取氨气的化学方程式______。
(2)收集氨气应使用______法,要得到干燥的氨气可选用作干燥剂______。
(3)如果只提供如图Ⅱ所示装置,请说明引发喷泉的方法是______。
Ⅱ.下图是甲、乙两位同学探究铜与稀硝酸反应还原产物的实验装置图,请回答下列问题:
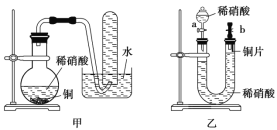
(1)写出铜和稀硝酸反应的离子方程式:______。
(2)实验装置甲能否证明铜和稀硝酸反应的产物是 NO 气体______(填“能”或“不能”),请简述理由(用文字和化学方程式表示):______。
(3)若用实验装置乙进行实验,检查装置气密性的操作是______。
【答案】2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O 向下排空气 碱石灰(或生石灰) 打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉 3Cu + 2NO3- + 8H+=3Cu2+ + 2NO↑ + 4H2O 不能 因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2:2NO+O2=2NO2 关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少量水后漏斗中的水不再下滴并能保持此状态一段时间,则说明该装置的气密性良好
CaCl2 + 2NH3↑ + 2H2O 向下排空气 碱石灰(或生石灰) 打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉 3Cu + 2NO3- + 8H+=3Cu2+ + 2NO↑ + 4H2O 不能 因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2:2NO+O2=2NO2 关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少量水后漏斗中的水不再下滴并能保持此状态一段时间,则说明该装置的气密性良好
【解析】
Ⅰ. (1)实验室常用熟石灰和氯化铵共热反应制氨气;
(2)根据氨气的密度选择收集方法,根据氨气水溶液呈碱性选择干燥剂;
(3)设法使氨气与水充分接触即可引发喷泉实验。
Ⅱ. (1)铜和稀硝酸反应生成NO,根据电子守恒、电荷守恒、质量守恒可写出该反应的离子方程式;
(2)实验装置甲的烧瓶内有氧气,能将NO氧化成NO2;
(3)可通过分液漏斗向U型管内加水检查装置气密性。
Ⅰ. (1)实验室常用NH4Cl和熟石灰共热制取氨气,方程式为:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O。
CaCl2 + 2NH3↑ + 2H2O。
答案为:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑ + 2H2O;
CaCl2 + 2NH3↑ + 2H2O;
(2)氨气密度比空气小,可用向下排空气法收集氨气;氨气为碱性气体,要得到干燥的氨气可选用的干燥剂为碱石灰(或生石灰)。
答案为:向上排空气;碱石灰(或生石灰);
(3)图Ⅱ所示装置中,导管中的空气使得氨气与水不能充分接触,要引发喷泉,可用热敷的方法:打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。
答案为:打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉;
Ⅱ. (1)铜和稀硝酸反应生成NO,根据电子守恒、电荷守恒、质量守恒可写出该反应的离子方程式为:3Cu + 2NO3- + 8H+=3Cu2+ + 2NO↑ + 4H2O。
答案为:3Cu + 2NO3- + 8H+=3Cu2+ + 2NO↑ + 4H2O;
(2)对比实验装置甲、乙可知,实验装置甲的烧瓶内有氧气,能将NO氧化成红棕色的NO2:2NO+O2=2NO2,所以,实验装置甲不能证明铜和稀硝酸反应的产物是 NO气体。
答案为:不能;因为烧瓶内有氧气,能氧化NO气体生成红棕色的NO2:2NO+O2=2NO2;
(3)可通过分液漏斗向U型管内加水检查装置气密性,具体操作为:关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少量水后漏斗中的水不再下滴并能保持此状态一段时间,则说明该装置的气密性良好。
答案为:关闭活塞b打开活塞a,通过分液漏斗向U型管内加水,若加入少量水后漏斗中的水不再下滴并能保持此状态一段时间,则说明该装置的气密性良好。