题目内容
19.一定条件下,在2L密闭容器中发生反应:N2+3H2$?_{催化剂}^{高温、高压}$2NH3,测得1min内,H2的物质的量由3mol减少到1.2mol,则1min内NH3的化学反应速率为( )| A. | 0.6 mol•L-1•min-1 | B. | 0.9 mol•L-1•min-1 | ||
| C. | 1.2 mol•L-1•min-1 | D. | 1.8 mol•L-1•min-1 |
分析 根据v=$\frac{△c}{△t}$计算v(H2),再利用速率之比等于其化学计量数之比计算v(NH3).
解答 解:测得1min内,H2的物质的量由3mol减少到1.2mol,则:v(H2)=$\frac{\frac{3mol-1.2mol}{2L}}{1min}$=0.9 mol•L-1•min-1,利用速率之比等于其化学计量数之比,则v(NH3)=$\frac{2}{3}$v(H2)=$\frac{2}{3}$×0.9 mol•L-1•min-1=0.6 mol•L-1•min-1,故选A.
点评 本题考查化学反应速率有关计算,比较基础,注意定义法与速率规律进行计算,根据情况选择合适计算方法.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案
相关题目
16.在AlCl3溶液中存在着平衡体系:Al3+3H2O?Al(OH)3+3H+,改变条件,填写表(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)
| 平衡移动方向 | C(Al3+) | n(H+) | c(H+) | |
| 通入HCl | ||||
| 加少量NaOH | ||||
| 加少量Na2CO3 | ||||
| 加水稀释 | ||||
| 升高温度 |
10.在醋酸中存在电离平衡:CH3COOH?CH3COO-+H+,要使电离平衡右移且c(CH3COO-)增大,应采取的措施是( )
| A. | 加入盐酸 | B. | 加入NaOH(s) | C. | 加蒸馏水 | D. | 升高温度 |
7.分别放在0.1mol•L-1H2SO4溶液中的四块相同的纯锌片,其腐蚀速率由快到慢的顺序是( )
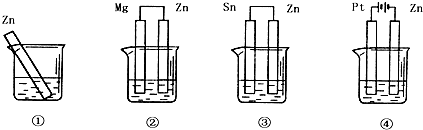

| A. | ④>③>②>① | B. | ③>①>②>④ | C. | ④>③>①>② | D. | ②>③>④>① |
14.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,22.4 LH2O中含有的分子数为NA | |
| B. | 1mol•L-1Na2CO3溶液中含有的钠离子数为2NA | |
| C. | 28gN2中含有的原子数为NA | |
| D. | 1molMg与足量稀盐酸反应,转移的电子数为2NA |
11.下列叙述正确的是( )
| A. | 二氧化硅常被用来制造光导纤维和石英表中的压电材料 | |
| B. | 各国工业大量排放二氧化硫是全球气候变暖的主要原因 | |
| C. | 食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼 | |
| D. | 氯元素,禁入口中 |
8.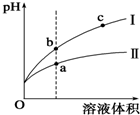 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH值变化曲线 | |
| B. | b点酸的总浓度大于a点酸的总浓度 | |
| C. | a点Kw的数值比c点Kw的数值大 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
9.下列各组离子能大量共存于同一溶液中,且加入适量NaOH溶液或少量稀硫酸时,都能产生白色沉淀的是( )
| A. | Cu2+、Ba2+、NO3-、Cl- | B. | Mg2+、Na+、CO32-、SO42- | ||
| C. | Fe3+、Ba2+、NO3-、SO42- | D. | Ba2+、Mg2+、NO3-、Cl- |

 →
→ +HBr.
+HBr. )是一种医药中间体.请设计合理方案用茴香醛(
)是一种医药中间体.请设计合理方案用茴香醛( )合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).
)合成D(其他原料自选,用反应流程图表示,并注明必要的反应条件).