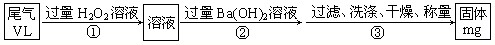题目内容
如下图所示,图(Ⅰ)中瓶a内放入20 mL 6 mol/L盐酸,b是未充气的气球,里边放有4 g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).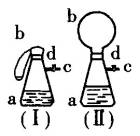
将图(Ⅰ)的装置放在托盘天平上称量,质量为![]() g.根据实验现象填写下列空白:
g.根据实验现象填写下列空白:
(1)把气球b中的碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ).反应结束后,再次称量,质量为![]() .则
.则![]() 和
和![]() 的关系是_____________.
的关系是_____________.
(2)取25 mL6 mol/LNaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为便于操作,可以适当倾斜瓶a,注意防止漏气).打开d,将溶液挤入瓶中,立即夹紧d.可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失.用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失.使沉淀消失的反应的化学方程式是____________________.
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解.此时瓶内温度_____________(填“不变”、“降低”或“升高”).
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状.写出这时发生的反应的化学方程式_____________.
解析:
| (1)
|
提示:
| (1)如果仅从反应前后的质量变化考虑,根据“质量守恒定律”,(Ⅰ)和(Ⅱ)的质量关系应当相等.
(2)由于CaCO34
g即0.04 mol,而6 mol/L盐酸20mL相当于0.12 mol,因此在反应中盐酸是过量的(过量0.04 mol).这时,在滴入少量氢氧化钠溶液时,摇匀前由于局部氢氧化钠过浓,可以观察到有少量Ca(OH)2白色沉淀生成,而轻摇瓶a后 (3)由于酸碱中和放热,使瓶内温度升高. (4)因为反应物CaCO3的总量是0.04
mol,所以当CaCO3与过量盐酸反应后,产生的CO2为0.04
mol;加入的氢氧化钠总量为0.15 mol,除中和过量盐酸消耗0.04 mol、生成Ca(OH)2沉淀消耗0.08 mol外,还剩余0.03
moL氢氧化钠,因此要使气球缩小至和反应前一样(即吸收掉全部
|

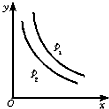 反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )
反应:L(s)+aG(g)?bR(g)达到平衡时,温度和压强对该反应的影响如下图所示,图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数.据此可判断( )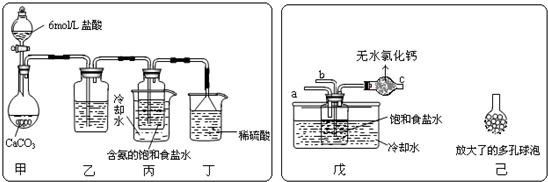
 硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放.某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案: