题目内容
1.ClO3F的结构属于( )| A. | 线型 | B. | 平面四边 | C. | 平面三角 | D. | 四面体 |
分析 根据价层电子对互斥理论确定ClO3F的结构,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数,当价层电子对个数等于2,sp杂化,立体构型为线型;价层电子对个数是4,含2对孤对电子,为平面四边形,当价层电子对个数等于3,没有孤对电子,采取sp2杂化,空间结构为平面正三角形,价层电子对个数是4,采取sp3杂化,不含孤电子对立体构型为四面体.
解答 解:ClO3F中心的氯原子的价层电子对个数=σ键个数+孤电子对个数=4+$\frac{7-3×2-1}{2}$=4,采取sp3杂化,不含孤电子对立体构型为四面体,
故选D.
点评 本题考查了原子杂化方式及分子的立体构型的判断,侧重分子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子中原子的杂化及空间构型为解答的关键,题目难度中等.

练习册系列答案
相关题目
12.如图是电解NaCl溶液(加有酚酞)装置,其中c、d为石墨电极.下列有关的判断正确的是( )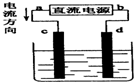

| A. | 电解过程中,d电极附近溶液变红 | |
| B. | c电极上的电极反应式为:2H++2e-=2H2↑ | |
| C. | a为负极、d为阳极 | |
| D. | 电解过程中,氯离子浓度不变 |
9.已知甲、乙装置中的电解质溶液足量,盐桥中盛装饱和氯化钾溶液,用琼脂固定,下列说法正确的是( )
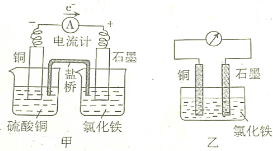

| A. | 甲、乙装置中的负极(或正极)反应式不同 | |
| B. | 放电少许时间后,甲、乙装置石墨极质量均增加 | |
| C. | 放电少许时间后,甲装置左边烧杯中含有两种溶质 | |
| D. | 甲、乙装置的能量转化形式不同 |
6.下列说法正确的是( )
| A. | 0.1mol•L-1NH4HCO3溶液中:c(NH4+)+c(H+)=c(OH-)+c(HCO3-) | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 | |
| D. | 欲使Na2S溶液中c(Na+)于c(S2-)的比值恰好为2:1,可加入适量的KHS溶液 |
1.已知某反应的各物质浓度数据如下:
aA(g)+bB(g)?2C(g)
起始浓度(mol/L) 3.0 1.0 0
2s末浓度(mol/L) 1.8 0.6 0.8
据此可推算出上述方程式中各物质的计量数之比是( )
aA(g)+bB(g)?2C(g)
起始浓度(mol/L) 3.0 1.0 0
2s末浓度(mol/L) 1.8 0.6 0.8
据此可推算出上述方程式中各物质的计量数之比是( )
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
2.下列物质与CH3CH2OH互为同系物的是( )
| A. | H-OH | B. | CH3OH | C. |  | D. | CH3OCH3 |
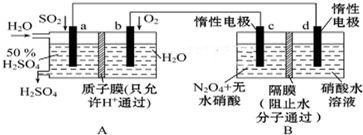
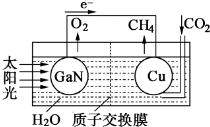 ,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
,利用该装置成功地实现了以CO2和H2O合成CH4.写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(填“盐酸”或“硫酸”).
 .(相对原子量:C-12 H-1)
.(相对原子量:C-12 H-1)