题目内容
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y在周期表中的位置为 ,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)
(2)XY2是一种常用的溶剂,XY2的电子式为 ,在HY、HZ两种共价键中,键的极性较强的是 .(写化学式)
(3)W的基态原子外围电子排布式是 .
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相同 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,XY2的电子式为
(3)W的基态原子外围电子排布式是
分析:X、Y、Z、W是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为硫元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为63,中子数为34,则其质子数=63-34=29,则W为Cu元素,据此解答.
解答:解:X、Y、Z、W是元素周期表前四周期中的四种常见元素,X的基态原子核外3个能级上有电子,且每个能级上的电子数相同,X原子核外电子排布式为1s22s22p2,则X为碳元素;常温常压下,Y单质是淡黄色固体,常在火山口附近沉积,则Y为硫元素;Z和Y同周期,Z的电负性大于Y,则Z为Cl元素;W的一种核素的质量数为63,中子数为34,则其质子数=63-34=29,则W为Cu元素,
(1)Y为硫元素,在周期表中的位置为:第三周期ⅥA族,非金属性Cl>S,故酸性HClO4>H2SO4,故答案为:第三周期ⅥA族;HClO4;
(2)CS2是一种常用的溶剂,结构与CO2类似,CS2的电子式为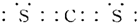 ,在H-S、H-Cl两种共价键中,Cl元素的电负性更大,对键合电子的吸引力更强,故H-Cl键的极性较强,
,在H-S、H-Cl两种共价键中,Cl元素的电负性更大,对键合电子的吸引力更强,故H-Cl键的极性较强,
故答案为: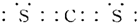 ;H-Cl;
;H-Cl;
(3)W为Cu元素,质子数为29,原子核外电子数为29,基态原子核外电子排布为1s22s22p63s23p63d104s1,基态原子外围电子排布式为3d104s1,
故答案为:3d104s1.
(1)Y为硫元素,在周期表中的位置为:第三周期ⅥA族,非金属性Cl>S,故酸性HClO4>H2SO4,故答案为:第三周期ⅥA族;HClO4;
(2)CS2是一种常用的溶剂,结构与CO2类似,CS2的电子式为
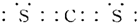 ,在H-S、H-Cl两种共价键中,Cl元素的电负性更大,对键合电子的吸引力更强,故H-Cl键的极性较强,
,在H-S、H-Cl两种共价键中,Cl元素的电负性更大,对键合电子的吸引力更强,故H-Cl键的极性较强,故答案为:
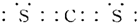 ;H-Cl;
;H-Cl;(3)W为Cu元素,质子数为29,原子核外电子数为29,基态原子核外电子排布为1s22s22p63s23p63d104s1,基态原子外围电子排布式为3d104s1,
故答案为:3d104s1.
点评:本题考查结构性质位置关系、电子式、化学键、元素周期律、核外电子排布规律等,难度不大,推断元素是解题关键,注意基础知识的全面掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目