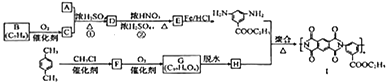
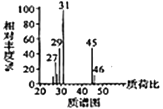
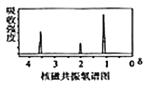
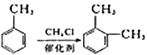
题目内容
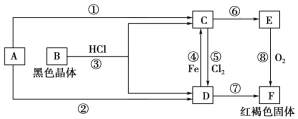
【题目】将赤铜矿(Cu2O)与辉铜矿(Cu2S)混合加热发生以下反应:2Cu2O+Cu2S![]() 6Cu+SO2↑,下列说法错误的是
6Cu+SO2↑,下列说法错误的是
A. 在Cu2O、Cu2S中Cu元素化合价都是+1价 B. 反应中Cu元素被氧化,S元素被还原
C. Cu2S在反应中既是氧化剂,又是还原剂 D. 每生成6.4gCu,反应中转移0.1mol e-
【答案】B
【解析】
由反应2Cu2O+Cu2S![]() 6Cu+SO2↑可知,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价,以此来解答。
6Cu+SO2↑可知,Cu元素的化合价由+1价降低为0,S元素的化合价由-2价升高为+4价,以此来解答。
A.在Cu2O和Cu2S中Cu元素的化合价都是+1价,A项正确;
B.反应中Cu元素的化合价由+1价降低到0价,铜元素被还原,S元素的化合价由-2价升高到+4价,硫元素被氧化,B项错误;
C.硫化亚铜中硫元素化合价升高,铜元素的化合价降低,所以Cu2S在反应中既是氧化剂,又是还原剂,C项正确;
D.根据化学反应2Cu2O+Cu2S![]() 6Cu+SO2↑可知硫元素化合价升高了6价,生成6mol铜转移了6mol电子,所以每生成6.4gCu即0.1mol铜,反应中转移0.1mol电子,D项正确;
6Cu+SO2↑可知硫元素化合价升高了6价,生成6mol铜转移了6mol电子,所以每生成6.4gCu即0.1mol铜,反应中转移0.1mol电子,D项正确;
答案选B。

 小题狂做系列答案
小题狂做系列答案【题目】下列实验能达到预期目的的是
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸分别测定浓度为18mol/L和0.1 mol/L H2SO4溶液的pH | 比较不同浓度H2SO4的酸性强弱 |
C | 配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
D | 向盛有1mL 0.01 mol/L | 证明在相同温度下的 Ksp(AgCl)>Ksp(AgI) |
A. A B. B C. C D. D
【题目】下图所示的实验,不能达到实验目的的是
A | B | C | D |
|
|
|
|
结合秒表测量锌与硫酸的反应速率 | 验证温度对化学平衡移动的影响 | 探究精炼铜的原理 | 证明酸性 CH3COOH>H2CO3>H3BO3 |
A. A B. B C. C D. D