��Ŀ����
����Ŀ��ˮ������Ҫ�Ľ������ϡ�ˮ�����ϵ���Ҫ�ɷ�ΪCaO��SiO2��������һ��������������þ�Ƚ����������ʵ���Ҳⶨˮ����Ʒ�иƺ����Ĺ�����ͼ��ʾ��
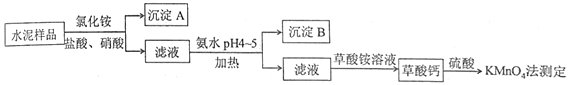
�ش��������⣺
��1���ڷֽ�ˮ����Ʒ�����У�������Ϊ�ܼ����Ȼ��Ϊ���ܼ���������뼸�����ᡣ���������Ŀ����__________������ʹ��___________�������ᡣ
��2������A����Ҫ�ɷ���_________���䲻����ǿ�ᵫ����һ�����ᷴӦ���÷�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
��3���Ӱ�ˮ�����м��ȵ�Ŀ����___________������B����Ҫ�ɷ�Ϊ_____________��____________���ѧʽ����
��4������Ƴ�����ϡH2SO4��������KMnO4����Һ�ζ���ͨ���ⶨ��������ɼ�ӻ�֪�Ƶĺ������ζ���ӦΪ�� ![]() +H++H2C2O4��Mn2++CO2+H2O��ʵ���г�ȡ0.400 gˮ����Ʒ���ζ�ʱ������0.0500 mol��L-1��KMnO4��Һ36.00 mL�����ˮ����Ʒ�иƵ���������Ϊ______________��
+H++H2C2O4��Mn2++CO2+H2O��ʵ���г�ȡ0.400 gˮ����Ʒ���ζ�ʱ������0.0500 mol��L-1��KMnO4��Һ36.00 mL�����ˮ����Ʒ�иƵ���������Ϊ______________��
���𰸡� ����Ʒ�п��ܴ��ڵ�Fe2+����ΪFe3+ ˫��ˮ(H2O2) SiO2 (��H2SiO3) SiO2+4HF![]() SiF4��+2H2O ��ֹ�������ɣ��׳������� Fe(OH)3
SiF4��+2H2O ��ֹ�������ɣ��׳������� Fe(OH)3 ![]() (OH)3 45.0%
(OH)3 45.0%
����������1������������Ϣ��ˮ���к���һ��������������þ�Ƚ������������������Ҫ��ȥ��Щ���ʣ���Ϊ Fe3+������pH��Сʱ�������������ʽ������������˼��������Ŀ���ǽ���Ʒ�п��ܴ��ڵ�Fe2��ת����Fe3���� ���������Ҫ���������ԣ�ͬʱ���������µ����ʣ���Ϊ�������ⱻ��Ϊ��ɫ�����������Կ���ѡ��˫��ˮ��
��2������ˮ���гɷ֣��������費����һ������Һ�����Գ���A�Ƕ������裻 SiO2��������ᣬ�����ķ�Ӧ�ǣ�SiO2+4HF![]() SiF4��+2H2O
SiF4��+2H2O
��3������ˮ�������ȷ�Ӧ�����ȿ��Դٽ�Fe3+��Al3+ˮ��ת��ΪFe(OH)3��![]() (OH)3����������ͼ��pH4��5ʱCa2+��Mg2+��������Fe3+��Al3+���������Գ���BΪFe(OH)3��
(OH)3����������ͼ��pH4��5ʱCa2+��Mg2+��������Fe3+��Al3+���������Գ���BΪFe(OH)3��![]() (OH)3��
(OH)3��
��4������ƵĻ�ѧʽΪCaC2O4��MnO4���������������ϼ۽���5�ۣ�H2C2O4�е�C���ϼ��ɣ�3�ۡ���4�ۣ���������2�ۣ���С������Ϊ10�� ���MnO4����ϵ��Ϊ2��H2C2O4��ϵ��Ϊ5�����ù�ϵʽ��5Ca2+��5H2C2O4��2KMnO4
n(KMnO4)=0.0500mol/L��36.00��10��3mL=1.80��10��3mol
n(Ca2+)=4.50��10��3mol
ˮ���иƵ���������Ϊ4.50��10��3mol��40.0g/mol/0.400g��100%=45.0%��

 ���б�ˢ��ϵ�д�
���б�ˢ��ϵ�д�