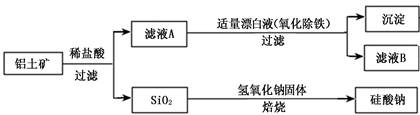
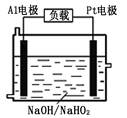
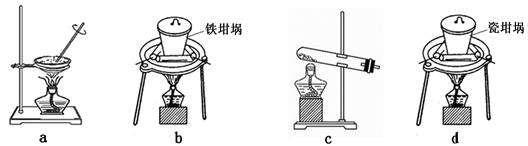
题目内容
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产生,则通入的气体可能是( )
| A.NH3 | B.Cl2 | C.CO2 | D.NO2 |
C
解析试题分析:A、通入NH3溶液呈碱性,溶液中生成大量的SO32-离子,生成沉淀BaSO3,错误; B、Cl2具有氧化性,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,错误;C、SO2与CO2都不与BaCl2反应,并且所对应的酸都比盐酸弱,通入SO2与CO2都不会生成沉淀,正确; D、NO2与水反应生成具有氧化性的硝酸,在溶液中将SO2氧化为SO42-离子,生成沉淀BaSO4,错误。
考点:本题考查物质的性质。

某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质R,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;
假设B:__________________________________________________________;
假设C:__________________________________________________________。
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中 加KSCN溶液 | | 固体物质中有FeCl3 |
| ②向R溶液中滴加 酸性KMnO4溶液 | | 固体物质中不含FeCl2 |
由此得出结论:假设________成立(填字母)。
(3)写出向R溶液中滴加少量KSCN溶液的离子方程式: 。25°C时,测得该反应达平衡时的平衡常数为K1,保持温度不变,继续滴加少量KSCN溶液,达新平衡时,测得平衡常数为K2,则K1 K2(填“>”,“<”或“=”),溶液的颜色 (填“变深”,“变浅”或“不变”)。
(4)R溶液常作印刷电路铜板的腐蚀剂,写出该反应的离子方程式:___________________________。
除去氯气中混有的少量的氯化氢气体,最好选用
| A.水 | B.饱和食盐水 |
| C.纯碱溶液 | D.饱和烧碱溶液 |
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2,下列说法中错误的是 ( )
| A.用该方法检验管道泄漏处会产生白烟 |
| B.管道泄漏处会闻到刺激性气味 |
| C.该反应生成1mol氮气时,转移3mol电子 |
| D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害 |
下列方法中,不能用于实验室里制取氨气的是( )
| A.加热烧瓶中的浓氨水 |
| B.加热试管中的熟石灰和氯化铵固体的混合物 |
| C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
| D.加热试管中的氯化铵固体,并将产生的气体通过装有碱石灰的干燥管 |
下列关于硅单质及其化合物的说法正确的是 ①硅是构成一些岩石和矿物的基本元素
①硅是构成一些岩石和矿物的基本元素 ②水泥、玻璃、水晶饰物都是硅酸盐制品
②水泥、玻璃、水晶饰物都是硅酸盐制品 ③高纯度的硅单质广泛用于制作光导纤维
③高纯度的硅单质广泛用于制作光导纤维  ④陶瓷是人类应用很早的硅酸盐材料
④陶瓷是人类应用很早的硅酸盐材料
| A.①② | B.②③ | C.①④ | D.③④ |
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应。二者比较,相等的是
① 铜片消耗完所需时间;② 反应生成的气体体积(标准状况);③ 反应中氧化剂得到的电子总数;④ 反应后溶液中铜离子的浓度
| A.①③ | B.②④ | C.③④ | D.只有① |
一定条件下磷与干燥氯气反应,若0.25 g磷消耗掉314 mL氯气(标准状况),则产物中PCl3与PCl5的物质的量之比接近于( )
| A.3∶1 | B.5∶3 | C.2∶3 | D.1∶2 |