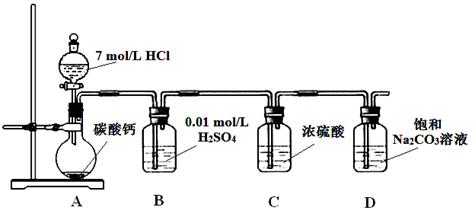
题目内容
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2,下列说法中错误的是 ( )
| A.用该方法检验管道泄漏处会产生白烟 |
| B.管道泄漏处会闻到刺激性气味 |
| C.该反应生成1mol氮气时,转移3mol电子 |
| D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害 |
C
解析试题分析:A.2NH3+3Cl2=6HCl+N2,HCl+ NH3= NH4Cl。总方程式是8NH3+3Cl2=6NH4Cl +N2,因此用该方法检验管道泄漏处会产生白烟,正确;B.管道泄漏处会有氯气,因此能够闻到刺激性气味,正确;C.由于N元素的化合价在反应前是-3价,在反应后化合价为0价,所以每生成1mol氮气时,转移6mol电子,错误;D.氯气能够与碱发生反应产生,所以可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害,正确。
考点:考查氯气的管道泄漏时的检验方法及反应原理的知识。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
五种常见物质X、Y、Z、E、F均含有同一元素M,已知Y是单质,Z是NO(一氧化氮),在一定条件下它们有如下转化关系,下列推断不合理的是 ( )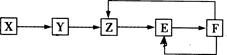
| A.M元素可能是非金属元素,也可能是金属元素 |
| B.X可能是一种氢化物 |
| C.E可能是一种有色气体 |
| D.X→Y可能是非氧化还原反应 |
下列物质中,可以用于制造半导体的是
| A.铝 | B.石墨 | C.晶体硅 | D.二氧化硅 |
将SO2气体通入BaCl2溶液至饱和,未见有沉淀生成,继续通入另一种气体仍无沉淀产生,则通入的气体可能是( )
| A.NH3 | B.Cl2 | C.CO2 | D.NO2 |
“绿色化学”又称环境无害化学、环境友好化学、清洁化学,某化学课外小组利用废铜制取硫酸铜,设计了如下制取方案,其中符合“绿色化学”要求的是( )
A.Cu CuSO4 CuSO4 |
B.Cu CuSO4 CuSO4 |
C.Cu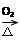 CuO CuO CuSO4 CuSO4 |
D.Cu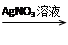 Cu(NO3)2 Cu(NO3)2 Cu(OH)2 Cu(OH)2 CuSO4 CuSO4 |
勤洗手和经常对环境进行消毒是预防传染病的有效途径。2012年4月,H7N9疫情爆发,可以用某种消毒液进行消毒,预防传染。已知该消毒液为无色液体,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是
| A.KMnO4 | B.H2O2 | C.NaClO | D.NH3·H2O |