题目内容
某矿样含有大量的CuS、少量铁的氧化物及少量其他不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl2·2H2O晶体。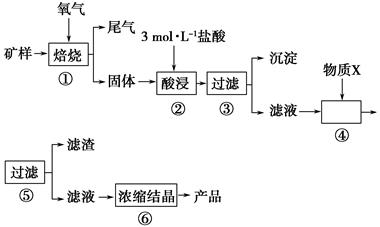
已知:在20 ℃时,氯化铜的溶解度是73 g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
回答下列问题:
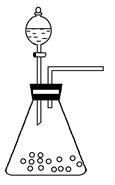
(1)步骤①的焙烧过程中需要通入氧气。在实验室中使用中学化学常见物质,用如图所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式:______________________、________________________;
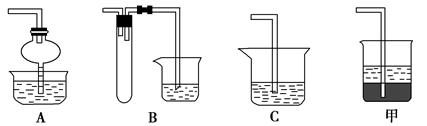
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物。若在实验室中用碱液吸收处理,下列A、B、C装置中可行的是________(填字母);若选用甲装置,则烧杯中的下层液体可以是________。
(3)步骤②酸浸过程中,需要用到3 mol·L-1的盐酸100 mL,配制该盐酸时。除了用到烧杯、玻璃棒、胶头滴管外,还需要用到的仪器有________________。
(4)步骤④加入物质X的目的是______________________________________,物质X可以选用下列物质中的________。
A.氧化铜 B.稀盐酸
C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行________次过滤操作。
(1)2H2O2 2H2O+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
2H2O+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
(2)AB 四氯化碳
(3)100 mL容量瓶、量筒
(4)调控溶液的pH,使Fe3+以Fe(OH)3沉淀的形式析出 A
(5)3
解析

为检验一批因露置而部分变质的Ba(OH) 2药品的成分,某化学探究性学习小组设计了方案对其进行分析:将20.45g药品分成五等分,逐渐加入100mL1 mol/L的盐酸中,并充分搅拌,测得生成气体的体积(已换算为标准状况下)、剩余固体的量与固体加入量的关系如图所示。考虑到某地附近为硫酸工业区,该小组同学判断此药品可能含三或四种成分。
(1) 写出硫酸工业尾气与过量的Ba(OH) 2反应的离子方程式:
(2)提出以下三种合理假设:(已知在空气中Ba(OH) 2很难生成酸式盐)
假设一:药品成分为Ba(OH) 2和BaSO4、BaSO3;假设二:药品成分为Ba(OH) 2和________________;
假设三:药品成分为Ba(OH) 2和________________。
(3)实验验证:为确定该药品的成分,该小组利用上述实验中生成的气体,选择适当的试剂进行探究,请设计合理方案填入下表:
| 实验操作 | 预期实验现象和结论 |
| | 若____________________,假设一成立; 若____________________,假设二成立; 若____________________,假设三成立。 |
(4)问题讨论:若经试验验证,此药品为四种成分混合物,该小组同学认为由上述曲线可知,当所加固体质量为12.27 g时,药品成分与盐酸刚好完全反应,你认为该组同学的判断是否正确______。(填“是”或者“否”)
阿司匹林(乙酰水杨酸,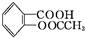 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135 ℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
乙酸酐+水杨酸
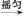
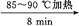
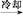
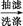 粗产品
粗产品
 乙酰水杨酸
乙酰水杨酸
(阿司匹林) 测熔点
测熔点
主要试剂和产品的物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
(1)制备阿司匹林时,要使用干燥的仪器的原因是 。
(2)①合成阿司匹林时,最合适的加热方法是 。
②加热后冷却,未发现被冷却容器中有晶体析出,此时应采取的措施是 。
③抽滤所得粗产品要用少量冰水洗涤,则洗涤的具体操作是 。
(3)试剂A是 。
另一种改进的提纯方法如下:
粗产品

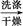 乙酰水杨酸
乙酰水杨酸(4)改进的提纯方法中加热回流的装置如图所示,
①使用温度计的目的是 。
②此种提纯方法中乙酸乙酯的作用是: ,所得产品的有机杂质要比原方案少,原因是 。
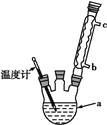
苯甲酸常用于抗真菌及消毒防腐。实验室常用高锰酸钾氧化甲苯制备苯甲酸,其装置如图甲所示(加热、搅拌和仪器固定装置均已略去)。实验过程如下:
①将5.4 mL甲苯、100 mL水、几粒沸石加入250 mL三颈烧瓶中;
②装上冷凝管,加热至沸后分批加入16 g高锰酸钾,回流反应4 h;
③将反应混合物趁热减压过滤,并用热水洗涤滤渣,将洗涤液并入滤液中;
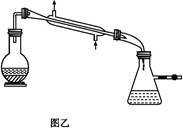
④滤液加入盐酸酸化后,抽滤(装置如图乙)、洗涤、干燥得苯甲酸粗产品。
在苯甲酸制备过程中发生反应: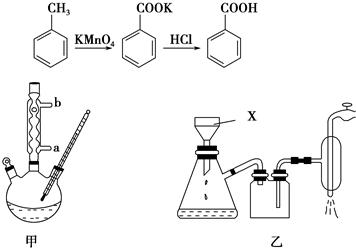
(1)图甲冷凝管中冷水应从________(填“a”或“b”)管进入,图乙中仪器X的名称为________。
(2)实验中分批加入KMnO4的原因是_________________________。
(3)判断甲苯被氧化完全的实验现象是___________________________。
(4)抽滤操作与普通过滤相比,除了得到沉淀较干燥外,还有一个优点是__________________________________________________________。
(5)第一次过滤时,若溶液呈红色,可加入下列试剂处理________(填字母)。
| A.H2O | B.CCl4 |
| C.NaHSO3 | D.HNO3 |
| T/℃ | 4 | 18 | 75 |
| 溶解度/g | 0.18 | 0.27 | 2.20 |
洗涤苯甲酸晶体时应用________洗涤。
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂,该晶体具有Na2CO3和H2O2的双重性质。利用图-2装置制备过碳酸钠,在冷水浴中充分反应后,按图-1流程可获得过碳酸钠产品。

(1)恒压滴液漏斗中支管的作用是 。
(2)制备过碳酸钠的关键是 。
(3)如果配制过碳酸钠的水中含有铁离子,不仅会削弱洗涤剂的去污能力,甚至完全失去杀菌作用。试分析其中的原因(写出其中一种即可,用方程式表示)。________________________________;
(4)某化学学习小组为了定性探究铁离子对这种新型漂白剂的不良影响,取该漂白剂100mL,加入25g FeCl3固体,产生大量无色无味气体,用贮气瓶收集气体。请选用下列试剂和实验用品完成气体成分的探究过程:0.1mol/LNaOH溶液、8.0mol/LNaOH溶液、澄清石灰水、0.01mol/LKMnO4溶液、BaCl2稀溶液、品红溶液、蒸馏水、木条、酒精灯、火柴、洗气瓶。
①提出假设:对该气体成分提出合理假设。
假设1:气体是O2; 假设2:气体是______________; 假设3:气体是CO2。
②设计方案:设计实验方案证明你的假设,在下表中完成实验步骤、预期现象与结论:
| 实验步骤 | 预期现象与结论 |
| 将气体依次通入盛有_______、________的洗气瓶中,________________________。 | ①________________________ ②________________________ ③________________________ |





 2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
2BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。