题目内容
Ⅰ、某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图1为某实验小组设计的原电池 装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
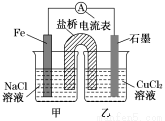
(2)如图,其他条件不变,若将乙烧杯中的CuCl2溶液换为NH4Cl溶液,则石墨电极的电极反应方程式为_____________________

(3)如图,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如下图所示乙装置中与铜丝相连的石墨电极上发生的反应方程式为_____________________
Ⅱ、氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油等燃料相比,氢气作为燃料的两个明显的优点是________________(写两点)
(2)化工生产的副产品也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气。总反应方程式为:Fe+2H2O+2OH? FeO42?+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42?,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42?+3H2↑,工作原理如下图1所示。装置通电后,铁电极附近生成紫红色的FeO42?,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH?)降低的区域在________________(填“阴极室”或“阳极室”)
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na2FeO4)低于最高值的原因:_____________。
练习册系列答案
相关题目