题目内容
【题目】热激活电池可用作火箭、导弹的工作电源。该电池以Ca为负极,熔融无水LiClKCl混合物作电解质,结构如图所示。正极反应式为PbSO4+2Li++2e-===Li2SO4+Pb。下列说法不正确的是( )
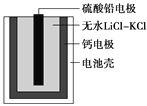
A. 放电过程中,Li+向正极移动
B. 常温下电解质是不导电的固体,电池不工作
C. 每转移0.1 mol电子,理论上生成20.7 g Pb
D. 该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb
【答案】C
【解析】放电过程中,阳离子移向正极,Li+向正极移动,故A正确;常温下,电解质不能融化,不能形成原电池,故指针不偏转,故B正确;每转移0.1mol电子,生成0.05mol Pb,为10.35g,故C错误;电池以Ca为负极,电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb,故D正确。

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目

