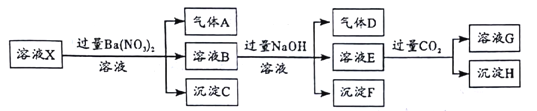
题目内容
【题目】某实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(1)通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
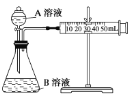
序号 | A溶液 | B溶液 |
① | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
② | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
该实验探究的是___对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是___(用实验序号填空)。
(2)某组同学利用如图完成该实验。请分析导管a的两点作用:①___;②___。
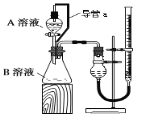
【答案】浓度和催化剂 ③>②>① 平衡气压,使分液漏斗内液体顺利流下 消除由于液体的加入引起气体体积测量的误差
【解析】
(1)对比实验①和实验②,所用试剂只有草酸的浓度不同,因此是在探究浓度对反应速率的影响,对比实验②和实验③,所用试剂只有溶液B中加有少量的硫酸锰,因此是在探究催化剂对反应速率的影响,三组实验探究了浓度和催化剂两个因素对反应速率的影响。实验①和实验②中,实验②的H2C2O4浓度大,其他条件不变时增大反应物浓度、化学反应速率加快,反应速率:实验②>实验①,实验②和实验③中,实验③使用了催化剂,则反应速率:实验③>实验②,因此三组实验的反应速率由大到小的顺序为:③>②>①,则相同时间内针管中所得CO2的体积由大到小的顺序是③>②>①;故答案为:温度和催化剂;③>②>①。
(2)图中导管a连通分液漏斗和锥形瓶,可保持漏斗内压强和锥形瓶内的压强始终相同,这样有利于分液漏斗中的液体顺利流下,同时滴入的液体所占体积气体进入分液漏斗中,不会对产生气体的体积产生影响,使测量气体体积更准确,故答案为:平衡气压,使分液漏斗内液体顺利流下;消除由于液体的加入引起气体体积测量的误差。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案